TARLATAMAB TRAS LA APROBACIÓN COMPLETA EN ESTADOS UNIDOS PARA EL TRATAMIENTO SMALL CELL LUNG CANCER EXTENSIVE-STAGE ... AHORA LE TOCA EL TURNO DE CONSEGUIR LA FULL APPROVAL EN EUROPA ... LA EMA PODRÍA DAR SU BENDICIÓN EN LA REUNIÓN DE MARZO .
31 marzo 2017
PharmaMar sigue en Cabecera de Pista pero sin Permiso para Despegar desde Torre .
Invertir y especular.com :
No sabemos a qué espera , por quien espera ... por el momento en cabecera de pista pero sin permiso para despegar desde torre.
Si rompe próxima escala a 3.60 euros, por el momento clara resistencia por arriba y mínimos ascendentes por abajo.
治疗铂类耐药/难治的卵巢癌,PM01183优于拓扑替康 发布时间: 2017-03-30 来源:中国癌症防治网 .
 一种名为PM01183的新型化合物在其Ⅱ期临床试验上,在铂类耐药/难治的卵巢癌患者中表现出了令人期待的抗肿瘤活性。
一种名为PM01183的新型化合物在其Ⅱ期临床试验上,在铂类耐药/难治的卵巢癌患者中表现出了令人期待的抗肿瘤活性。PM01183是一种人造的四氢异喹啉化合物,可以选择性抑制活跃转录,影响包括DNA断裂、凋亡,并且可以参与炎性微环境的调控。在前临床试验阶段,PM01183在上皮卵巢癌来源模型中表现出了强抗肿瘤活性。
研究团队开展了这项Ⅱ期临床试验,探究PM01183在铂类耐药/难治型卵巢癌患者中的有效性及安全性,试验结果发表在Annals of oncology上。
主要内容
该研究包括2个阶段,第一阶段为探索阶段,22名铂类耐药/难治的卵巢癌患者接受PM01183的单药治疗,用法为:PM01183 7.0mg IV d1(1小时) ,21d/cycle。
第二阶段将患者随机分配入PM01183 组(n=30) ,29名患者分配入拓扑替康组,后15名患者被交叉到PM01183 组 。
用法为:拓扑替康1.5-0.75mg/平方米,d1-5 21d/cycle(标准方案),或 4.0-2.4mg/平方米, d1,7d/cycle(周方案)。(药量大小根据PS评分调整)
主要结果
在52名接受PM01183的患者中,12名确认缓解,包括1名CR和11名PR。客观缓解率(ORR)达23%。
中位缓解持续时间(DoR)为4.6个月。23%缓解患者至少持续了6个月以上。中位无进展生存(PFS)时间为4.0个月。中位总生存期(OS)为10.6个月。
在取得缓解的患者中,大多数基线ECOG评分为0,大多数为65岁以下。83%患者铂类耐药。2名有BRCA突变。
在铂类耐药的33名患者中,ORR达33%,中位PFS达5.0个月。
在随机阶段患者中,在29名接受拓扑替康化疗的患者中,未见缓解者。
PM01183组的中位PFS为3.9个月,而拓扑替康为2.0个月。
两组的OS分别为9.7个月和8.5个月,PM01183组OS稍长。
安全性方面,骨髓抑制使PM01183的最常见副反应。3/4度骨髓移植见于85%的PM01183患者(4度骨髓移植达64%),3/4度血小板减少发生率为33%。
全级别乏力的发生率为77%,是最常见的非血液学毒性。1名患者出现治疗相关的横纹肌肉瘤。无治疗相关死亡发生。
小结
PM01183在铂类耐药/难治的卵巢癌患者中很有效,尤其是在铂类耐药患者中,它的抗肿瘤活性很高,达到了较好的缓解率和生存数据。
但是其Ⅱ期结果表明,该药骨髓抑制风险较大,缓解的患者大部分基线ECOG评分为0分,年龄小于65岁,需要进一步的临床试验提供更多的数据来指导PM01183的应用。
目前,该药正在进行名为CORAIL的Ⅲ期临床试验,其中也包括铂类耐药的卵巢癌患者,我们会继续跟进结果。
Día Mundial del Cáncer de Colon : esto es lo que los Españoles saben sobre la enfermedad .
"Si un mayor de 50 años tiene sangre en heces debe consultar" .
A pesar de la gran cantidad de mitos que están asociados a esta enfermedad, la mayoría de la población española sabe diferenciar entre lo que es falso y lo que es cierto .
 EP Madrid // 30/03/2017 .
EP Madrid // 30/03/2017 .
El Cáncer de Colon es el más frecuente en España pero no el más conocido de forma específica por la población, según los datos que arroja la encuesta nacional que ha presentado este jueves la Fundación Merck Salud de mano de su presidenta ejecutiva, Carmen González Madrid.
A pesar de que no es el más predominante, el cáncer de mama es conocido por el 97 por ciento de la población, el de pulmón por el 95 por ciento, el de piel por el 93 por ciento, el de colon por el 74 por ciento, y el de cabeza y cuello por el 42 por ciento. Esto supone que no hay una correspondencia entre la prevalencia y el conocimiento que tiene la población.
En general, en todos los campos el nivel de conocimiento aumenta en los casos en los que los encuestados tiene contacto directo con algún paciente de cáncer, haber padecido la enfermedad o estarla padeciendo como paciente.
Dentro del 74 por ciento que conoce el cáncer colorrectal, el 91 por ciento lo localiza en el colon, el 69 por ciento lo hace en el colon y en el recto. El 45 por ciento de la población conoce los síntomas más frecuentes de este cáncer.
A pesar de la gran cantidad de mitos que están asociados a esta enfermedad, la mayoría de la población española sabe diferenciar entre lo que es falso y lo que es cierto. Los encuestados opinan que no siempre es mortal, no siempre es hereditario, que la diabetes y la obesidad son factores de riesgo y que aunque no haya síntomas sigue habiendo riesgo de padecerlo. Destaca que la mitad de la población afirma que se reduce el riesgo de padecerlo si no se consume carne roja.
Acerca de los tratamientos, el 42 por ciento conoce alguno de los tratamientos para el cáncer colorrectal, siendo los más conocidos la cirugía y la quimioterapia. Sólo un 15 por ciento reconoce un agente biológico como tratamiento. Por otro lado, la metástasis es reconocida por un 84 por ciento. Respecto a los biomarcadores oncológicos, el 43 por ciento dice conocerlos pero solo el 28 por ciento saben que existe en el cáncer de colon.
Cuando a los encuestados se les pregunta sobre la biopsia líquida, el 80 por ciento de la población no sabe lo que es. Y del 20 por ciento que los conoce, sólo el 35 por ciento la conoce en los pacientes de cáncer de colon.
...
A pesar de la gran cantidad de mitos que están asociados a esta enfermedad, la mayoría de la población española sabe diferenciar entre lo que es falso y lo que es cierto .
 EP Madrid // 30/03/2017 .
EP Madrid // 30/03/2017 .El Cáncer de Colon es el más frecuente en España pero no el más conocido de forma específica por la población, según los datos que arroja la encuesta nacional que ha presentado este jueves la Fundación Merck Salud de mano de su presidenta ejecutiva, Carmen González Madrid.
A pesar de que no es el más predominante, el cáncer de mama es conocido por el 97 por ciento de la población, el de pulmón por el 95 por ciento, el de piel por el 93 por ciento, el de colon por el 74 por ciento, y el de cabeza y cuello por el 42 por ciento. Esto supone que no hay una correspondencia entre la prevalencia y el conocimiento que tiene la población.
En general, en todos los campos el nivel de conocimiento aumenta en los casos en los que los encuestados tiene contacto directo con algún paciente de cáncer, haber padecido la enfermedad o estarla padeciendo como paciente.
Dentro del 74 por ciento que conoce el cáncer colorrectal, el 91 por ciento lo localiza en el colon, el 69 por ciento lo hace en el colon y en el recto. El 45 por ciento de la población conoce los síntomas más frecuentes de este cáncer.
A pesar de la gran cantidad de mitos que están asociados a esta enfermedad, la mayoría de la población española sabe diferenciar entre lo que es falso y lo que es cierto. Los encuestados opinan que no siempre es mortal, no siempre es hereditario, que la diabetes y la obesidad son factores de riesgo y que aunque no haya síntomas sigue habiendo riesgo de padecerlo. Destaca que la mitad de la población afirma que se reduce el riesgo de padecerlo si no se consume carne roja.
Acerca de los tratamientos, el 42 por ciento conoce alguno de los tratamientos para el cáncer colorrectal, siendo los más conocidos la cirugía y la quimioterapia. Sólo un 15 por ciento reconoce un agente biológico como tratamiento. Por otro lado, la metástasis es reconocida por un 84 por ciento. Respecto a los biomarcadores oncológicos, el 43 por ciento dice conocerlos pero solo el 28 por ciento saben que existe en el cáncer de colon.
Cuando a los encuestados se les pregunta sobre la biopsia líquida, el 80 por ciento de la población no sabe lo que es. Y del 20 por ciento que los conoce, sólo el 35 por ciento la conoce en los pacientes de cáncer de colon.
...
Alzheimer . Evita cuanto puedas los envases o latas de aluminio pues están bajo sospecha de favorecer la enfermedad .
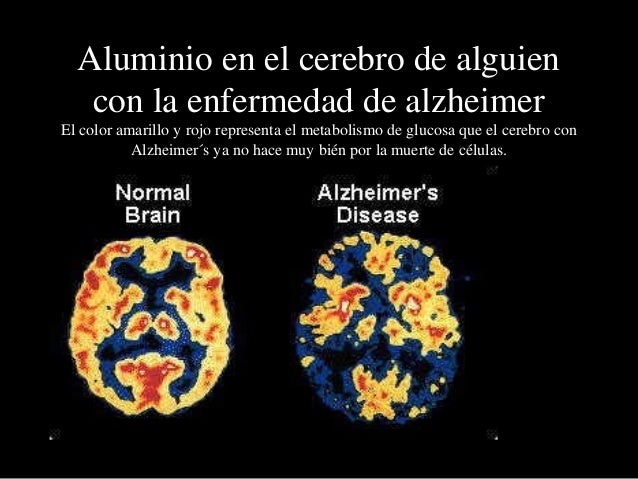 Rosa Guerrero
Rosa GuerreroDe los diversos tipos de demencia que afectan a la población española, el Alzheimer ocupa el primer puesto con un 53% del total. La siguen las demencias vasculares, con un 27%. Más concretamente, el Alzheimer afecta a una de cada diez personas mayores de 65 años y la prevalencia aumenta al 20% en los mayores de 80 años.
La enfermedad se caracteriza por la destrucción general de las células nerviosas en áreas clave del cerebro implicadas en las funciones mentales y cursa de manera lenta y progresiva. El proceso puede durar de 3 a 20 años, con un promedio de 7 a 8 años.
El trastorno se inicia con la acumulación en el cerebro de fragmentos anormales de una proteína llamada beta-amiloide. Esta se forma accidentalmente por la mala disolución de otra, la proteína precursora amiloidea (APP), que se halla de forma natural en las membranas celulares. La APP promueve la formación de células nerviosas y activa las sinapsis neuronales.
Esos fragmentos de proteína forman con el tiempo ovillos neurofibrilares que destruyen lentamente el hipocampo, el centro de los recuerdos. Gradualmente los ovillos se van extendiendo por el cerebro y afectan a otras funciones: la persona pierde la capacidad de decisión, la orientación y el lenguaje. En la etapa final se destruye la parte del cerebro que regula el corazón y la respiración.
Peligros del aluminio para la salud
Diversos estudios publicados, como el de la revista médica The Lancet (vol. 343, 23-Ab-94), confirrman el papel que desempeña el aluminio como precursor de la enfermedad de Alzheimer.
Este metal neurotóxico puede penetrar en el organismo por diversas vías: utensilios de cocina , alimentos enlatados, ciertos fármacos, desodorantes y otros productos cosméticos, vacunas e incluso a través del agua del grifo. Cantidades excesivas de aluminio, junto con una de ficiencia de minerales esenciales, predisponen a padecer la enfermedad.
Una vez este metal entra en el organismo resulta muy difícil expulsarlo, por lo se aconseja evitarlo al máximo.
30 marzo 2017
PharmaMar Organiza el 1 de abril la 2ª Edición del Congreso “Soft Tissue Sarcoma: Evidence & Experience” .
The European Society of Medical Oncology Recommends the Treatment of Sarcomas With Metastases With Yondelis ( Trabectedin ) .
* PharmaMar is conducting 17 post-authorization clinical trials with Trabectedin indicated for the treatment of adult with advanced Sarcoma
* Las Guías Clínicas de la Sociedad Europa de Oncología Médica Recomiendan Tratar el Sarcoma con Yondelis ( Trabectedin ) .
* Sarcoma: almost 50% of diagnosed patients present metastases or are expected to develop it shortly after cancer .
* Diagnoses of soft tissue sarcoma represent about 0.7% of all new cancer cases in the US, and account for 7-10% of paediatric cancers.
* Soft tissue sarcoma (STS) is a rare cancer, and between 4 and 5 cases per 100,000 adults are newly diagnosed in Europe each year.
* Cerca del 50% de los pacientes con sarcoma de tejidos blandos presenta metástasis o se espera que la desarrollen.
* Aunque el sarcoma de tejidos blandos puede aparecer en cualquier parte, se produce con mayor frecuencia (43%) en brazos y piernas .
* El Sarcoma es considerado un tumor raro. Cada año aparecen en Europa 4-5 nuevos casos cada 100.000 habitantes .
* PharmaMar is conducting 17 post-authorization clinical trials with Trabectedin indicated for the treatment of adult with advanced Sarcoma
* Las Guías Clínicas de la Sociedad Europa de Oncología Médica Recomiendan Tratar el Sarcoma con Yondelis ( Trabectedin ) .
* Sarcoma: almost 50% of diagnosed patients present metastases or are expected to develop it shortly after cancer .
* Diagnoses of soft tissue sarcoma represent about 0.7% of all new cancer cases in the US, and account for 7-10% of paediatric cancers.
* Soft tissue sarcoma (STS) is a rare cancer, and between 4 and 5 cases per 100,000 adults are newly diagnosed in Europe each year.
* Cerca del 50% de los pacientes con sarcoma de tejidos blandos presenta metástasis o se espera que la desarrollen.
* Aunque el sarcoma de tejidos blandos puede aparecer en cualquier parte, se produce con mayor frecuencia (43%) en brazos y piernas .
* El Sarcoma es considerado un tumor raro. Cada año aparecen en Europa 4-5 nuevos casos cada 100.000 habitantes .
Grifols tira de autocartera para financiar sus inversiones en biotecnológicas .
 En 2009, Grifols tenía en cartera un 2% de sus títulos, según comunicó a la CNMV. Siete años después, en 2016, este paquete se limita al 0,20% por esta operativa de adquisiciones .
En 2009, Grifols tenía en cartera un 2% de sus títulos, según comunicó a la CNMV. Siete años después, en 2016, este paquete se limita al 0,20% por esta operativa de adquisiciones .30.03.2017.
El gigante de hemoderivados Grifols ha ido tirando de autocartera como mecanismo para financiar sus inversiones en empresas biotecnológicas. Así, en los últimos años la cantidad de títulos propios en el balance de la empresa que preside Víctor Grifols ha ido cayendo en picado. En 2009, Grifols tenía en cartera un 2% de sus títulos, según comunicó a la CNMV. Siete años después, en 2016, este paquete se limita al 0,20%, tras haber pagado parte de las compras accionariales de la empresa suiza Medion o la vasca Progenika.
Esta información consta en los informes anuales de Grifols de 2016 y de 2015. Durante el pasado ejercicio Grifols utilizó 59.951 títulos de su autocartera para comprar el 20% de la empresa Medion. Esta adquisición estaba pendiente desde que en 2001 adquirió la empresa australiano-suiza Lateral-Medion. En el caso de la helvética Medion, se trataba de una empresa que había desarrollado una tecnología para la determinación de grupos sanguíneos complementaria con la de Grifols.
Antes, Grifols había abonado otras 876.777 acciones para comprar el 16,4% de la empresa vasca Progenika Biopharma, con lo que llegó al 89% en esta firma especialista en el desarrollo de pruebas de biología molecular para estudios de compatibilidad transfusional, y diagnostico de enfermedades genéticamente complejas. El pago en acciones supuso el 50% del precio de la operación.
Como en el caso de Medion, la compra de Progenika fue paulatina. En 2013 ya tenía el 60% pero contaba con acuerdos para seguir adquiriendo títulos. Esta es una estrategia habitua del Grifols con las pequeñas biotech: fasear las operaciones de compra.
No fue el único juego que le dio la autocartera a Grifols. En mayo del 2015 vendió más 1,9 millones de títulos en una operación puramente financiera por la que obtuvo unas plusvalías netas de dos millones de euros, que el grupo destinó a reservas.
Esta operación permitió compensar un cargo a reservas hecho previamente a causa de otra participada biotech, la aragonesa Araclon, especializada en el trastorno precoz de Alzheimer donde Grifols pasó del 66% al 70,8%, lo que supuso un cargo a reservas de 1,7 millones, que luego se equilibró con la venta de títulos en autocartera, anteriormente mencionada.
...
Blanes . SPONGES, CORALS & THE WORLD. INTERNATIONAL SYMPOSIUM ON MARINE SCIENCE, BLUE BUSINESS AND SOCIETY .
30 March
10.15-11.00 Fernando de la Calle (PharmaMar). Keynote: Marine biodiversity and biotechnology as source of antitumor compounds. The experience of PharmaMar.
...
10.15-11.00 Fernando de la Calle (PharmaMar). Keynote: Marine biodiversity and biotechnology as source of antitumor compounds. The experience of PharmaMar.
...
29 marzo 2017
PharmaMar Organiza el 2º Congreso Internacional : Soft Tissue Sarcoma: Evidence & Experience . Madrid 1 Abril .
The Success of Sarcoma Treatment, Seen by Prestigious International Oncologists .

* On April, 1st, Madrid will hold the second edition of the International Congress Soft Tissue Sarcoma: Evidence & Experience .
* The congress will gather oncologists from all around the world to analyze the different treatments to battle sracomas .
* Oncologists, radiologists and surgeons will expose their experience and the results obtained in this field .
Madrid, 29 de marzo de 2017 .
Oncólogos de todas partes del mundo se darán cita en Madrid el próximo 1 de abril en el marco de la segunda edición del congreso internacional Soft Tissue Sarcoma: Evidence & Experience, organizada por PharmaMar, con el fin de compartir los últimos avances en el manejo de los diferentes tipos de sarcoma de tejidos blandos (STB).
Como temas centrales de la jornada, los expertos asistentes, procedentes de Reino Unido, Francia, Alemania, Italia, España y Holanda, discutirán las diferencias observadas en la administración de las diversas opciones terapéuticas disponibles, y en particular el papel relevante que se recomienda otorgar al paciente en la toma de decisiones durante el tratamiento.
“Tener la oportunidad de reunir a este panel de expertos es un privilegio para PharmaMar como compañía comprometida en el tratamiento de los STB”, afirmó D. Luis Mora, Director General de la Unidad de Oncología de PharmaMar. “Trabajamos día a día por poner tratamientos innovadores a la disposición de los pacientes oncológicos, y contar con la contribución de expertos de este nivel nos hace ver que nuestro trabajo es de gran valor para la comunidad médica”, añadió.
Un tratamiento para cada subtipo de sarcoma
Ocasionalmente, la diversidad de subtipos de sarcomas pone en jaque a los equipos de profesionales sanitarios a la hora de determinar un tratamiento para combatir la enfermedad. En este sentido, los asistentes que participarán en el evento abordarán las opciones de tratamiento para hacer frente a los dos subtipos más comunes: los leiomiosarcomas y los liposarcomas.
En concreto, los leiomiosarcomas (LMS) representan el 16% de todos los STB, afectan más frecuentemente a adultos de mediana edad en adelante, predominan entre las mujeres, y pueden presentarse de manera uterina (U-LMS, por sus siglas en inglés) o no-uterina.
Los liposarcomas (LS) también serán objeto de análisis durante la jornada, ya que se plantean diferentes intervenciones en base a la clase de LS que cada paciente presenta.
Identificar el objetivo del tratamiento
Uno de los temas centrales de la reunión será la identificación de un objetivo terapéutico en función del estado en que se encuentre la enfermedad. En este punto los expertos analizarán qué aproximación tomar en pacientes tras una cirugía o en aquéllos que ya han sido previamente tratados.
Entre las opciones destacadas por los expertos en consonancia con las recomendaciones publicadas por la Red Europea de Sarcoma y la Sociedad Europea de Oncología Médica, trabectedina se presenta como una opción efectiva como segunda línea de tratamiento para todo tipo de sarcomas en estado avanzado. Este compuesto, desarrollado y comercializado por PharmaMar como Yondelis®, muestra una mayor tasa de control de la enfermedad, efectividad en el tratamiento a largo plazo y buena tolerancia por parte del paciente.
“Cuando el objetivo terapéutico es la estabilización del tumor a largo plazo manteniendo una buena calidad de vida del paciente, trabectedina muestra claros beneficios clínicos, tanto en LMS como en LS y otros tipos de STB”, afirma el Dr. Jean-Yves Blay, director del centro Léon Bérard en Lyon, Francia, y Presidente de la Organización Europea de Investigación y Tratamiento del Cáncer (EORTC, por sus siglas en inglés).
La calidad de vida del paciente como centro de la terapia
Los expertos también abordarán la calidad de vida del paciente como tema esencial en la evolución de los sarcomas. Tal y como afirma el Dr. Robin Jones, oncólogo del Royal Marsden Hospital y del Instituto de Investigación del Cáncer en Londres, “la calidad de vida de los pacientes relacionada con su estado de salud es un parámetro subjetivo y su medición es un reto para la práctica clínica”.
El Dr. Jones liderará una sesión centrada en evaluar cómo la calidad de vida de cada paciente puede ir midiéndose a lo largo del tratamiento, así como exponer los resultados de diferentes estudios en pacientes con sarcomas localizados y metastásicos. Uno de los factores que se ha demostrado que intervienen en la calidad de vida de los pacientes es la atención recibida por los profesionales sanitarios que se encargan de su cuidado.
Por ello, durante el evento, se presentará la estructura de un estudio actualmente en marcha llamado YonLife, el primer ensayo de prospección randomizado que analiza, en pacientes tratados con trabectedina, el impacto en la calidad de vida de aquéllos atendidos por un equipo multidisciplinar frente a los atendidos por un equipo convencional. Se prevé que se completará en diciembre de este año.
“El objetivo primario del estudio es observar si se produce un cambio en la medición de la calidad de vida de los pacientes tras nueve semanas de tratamiento”, explica el Dr. Jones, “este tipo de ensayos nos va a aportar un conocimiento excepcional sobre la calidad de vida de estos pacientes”.
El poder decisor del paciente
En línea con la importancia de la calidad de vida durante el tratamiento y el desarrollo de los sarcomas, el Dr. Axel Les Cesne, Director de la Unidad de Oncología Hérault y Presidente del Comité de Sarcoma y Tumores Mesenquimatosos, analizará cómo se vive con esta enfermedad desde el punto de vista del paciente.
Según el Dr. Les Cesne “el mayor problema para un paciente es que en muchos casos no puede recibir tratamiento de un especialista en sarcomas porque no tienen acceso a redes de profesionales sanitarios y centros especializados en ello”. También subraya la importancia de que las decisiones relativas al tratamiento se tomen por parte de un equipo multidisciplinar que incluya al propio paciente, no solo cuando la enfermedad está localizada, sino también cuando se presenta en un estado avanzado. “El paciente puede no querer continuar con el tratamiento si ve que su calidad de vida va a estar afectada”, apunta.
Como conclusión, el Dr. Le Cesne añade que la optimización de la eficacia de los tratamientos responde al algoritmo resultante de combinar factores procedentes tanto de la práctica clínica como del propio paciente. “Desde las características del paciente, la dosificación de los medicamentos, el tipo de sarcoma, la duración del tratamiento, la terapia de mantenimiento hasta el manejo de los efectos secundarios, forman parte del éxito o fracaso de un tratamiento. No es solamente la elección de un fármaco u otro lo que hace que un paciente responda mejor”, explicó.
...

* On April, 1st, Madrid will hold the second edition of the International Congress Soft Tissue Sarcoma: Evidence & Experience .
* The congress will gather oncologists from all around the world to analyze the different treatments to battle sracomas .
* Oncologists, radiologists and surgeons will expose their experience and the results obtained in this field .
Madrid, 29 de marzo de 2017 .
Oncólogos de todas partes del mundo se darán cita en Madrid el próximo 1 de abril en el marco de la segunda edición del congreso internacional Soft Tissue Sarcoma: Evidence & Experience, organizada por PharmaMar, con el fin de compartir los últimos avances en el manejo de los diferentes tipos de sarcoma de tejidos blandos (STB).
Como temas centrales de la jornada, los expertos asistentes, procedentes de Reino Unido, Francia, Alemania, Italia, España y Holanda, discutirán las diferencias observadas en la administración de las diversas opciones terapéuticas disponibles, y en particular el papel relevante que se recomienda otorgar al paciente en la toma de decisiones durante el tratamiento.
“Tener la oportunidad de reunir a este panel de expertos es un privilegio para PharmaMar como compañía comprometida en el tratamiento de los STB”, afirmó D. Luis Mora, Director General de la Unidad de Oncología de PharmaMar. “Trabajamos día a día por poner tratamientos innovadores a la disposición de los pacientes oncológicos, y contar con la contribución de expertos de este nivel nos hace ver que nuestro trabajo es de gran valor para la comunidad médica”, añadió.
Un tratamiento para cada subtipo de sarcoma
Ocasionalmente, la diversidad de subtipos de sarcomas pone en jaque a los equipos de profesionales sanitarios a la hora de determinar un tratamiento para combatir la enfermedad. En este sentido, los asistentes que participarán en el evento abordarán las opciones de tratamiento para hacer frente a los dos subtipos más comunes: los leiomiosarcomas y los liposarcomas.
En concreto, los leiomiosarcomas (LMS) representan el 16% de todos los STB, afectan más frecuentemente a adultos de mediana edad en adelante, predominan entre las mujeres, y pueden presentarse de manera uterina (U-LMS, por sus siglas en inglés) o no-uterina.
Los liposarcomas (LS) también serán objeto de análisis durante la jornada, ya que se plantean diferentes intervenciones en base a la clase de LS que cada paciente presenta.
Identificar el objetivo del tratamiento
Uno de los temas centrales de la reunión será la identificación de un objetivo terapéutico en función del estado en que se encuentre la enfermedad. En este punto los expertos analizarán qué aproximación tomar en pacientes tras una cirugía o en aquéllos que ya han sido previamente tratados.
Entre las opciones destacadas por los expertos en consonancia con las recomendaciones publicadas por la Red Europea de Sarcoma y la Sociedad Europea de Oncología Médica, trabectedina se presenta como una opción efectiva como segunda línea de tratamiento para todo tipo de sarcomas en estado avanzado. Este compuesto, desarrollado y comercializado por PharmaMar como Yondelis®, muestra una mayor tasa de control de la enfermedad, efectividad en el tratamiento a largo plazo y buena tolerancia por parte del paciente.
“Cuando el objetivo terapéutico es la estabilización del tumor a largo plazo manteniendo una buena calidad de vida del paciente, trabectedina muestra claros beneficios clínicos, tanto en LMS como en LS y otros tipos de STB”, afirma el Dr. Jean-Yves Blay, director del centro Léon Bérard en Lyon, Francia, y Presidente de la Organización Europea de Investigación y Tratamiento del Cáncer (EORTC, por sus siglas en inglés).
La calidad de vida del paciente como centro de la terapia
Los expertos también abordarán la calidad de vida del paciente como tema esencial en la evolución de los sarcomas. Tal y como afirma el Dr. Robin Jones, oncólogo del Royal Marsden Hospital y del Instituto de Investigación del Cáncer en Londres, “la calidad de vida de los pacientes relacionada con su estado de salud es un parámetro subjetivo y su medición es un reto para la práctica clínica”.
El Dr. Jones liderará una sesión centrada en evaluar cómo la calidad de vida de cada paciente puede ir midiéndose a lo largo del tratamiento, así como exponer los resultados de diferentes estudios en pacientes con sarcomas localizados y metastásicos. Uno de los factores que se ha demostrado que intervienen en la calidad de vida de los pacientes es la atención recibida por los profesionales sanitarios que se encargan de su cuidado.
Por ello, durante el evento, se presentará la estructura de un estudio actualmente en marcha llamado YonLife, el primer ensayo de prospección randomizado que analiza, en pacientes tratados con trabectedina, el impacto en la calidad de vida de aquéllos atendidos por un equipo multidisciplinar frente a los atendidos por un equipo convencional. Se prevé que se completará en diciembre de este año.
“El objetivo primario del estudio es observar si se produce un cambio en la medición de la calidad de vida de los pacientes tras nueve semanas de tratamiento”, explica el Dr. Jones, “este tipo de ensayos nos va a aportar un conocimiento excepcional sobre la calidad de vida de estos pacientes”.
El poder decisor del paciente
En línea con la importancia de la calidad de vida durante el tratamiento y el desarrollo de los sarcomas, el Dr. Axel Les Cesne, Director de la Unidad de Oncología Hérault y Presidente del Comité de Sarcoma y Tumores Mesenquimatosos, analizará cómo se vive con esta enfermedad desde el punto de vista del paciente.
Según el Dr. Les Cesne “el mayor problema para un paciente es que en muchos casos no puede recibir tratamiento de un especialista en sarcomas porque no tienen acceso a redes de profesionales sanitarios y centros especializados en ello”. También subraya la importancia de que las decisiones relativas al tratamiento se tomen por parte de un equipo multidisciplinar que incluya al propio paciente, no solo cuando la enfermedad está localizada, sino también cuando se presenta en un estado avanzado. “El paciente puede no querer continuar con el tratamiento si ve que su calidad de vida va a estar afectada”, apunta.
Como conclusión, el Dr. Le Cesne añade que la optimización de la eficacia de los tratamientos responde al algoritmo resultante de combinar factores procedentes tanto de la práctica clínica como del propio paciente. “Desde las características del paciente, la dosificación de los medicamentos, el tipo de sarcoma, la duración del tratamiento, la terapia de mantenimiento hasta el manejo de los efectos secundarios, forman parte del éxito o fracaso de un tratamiento. No es solamente la elección de un fármaco u otro lo que hace que un paciente responda mejor”, explicó.
...
Amancio Ortega dona 320 millones para la compra de equipos oncológicos . Post by Celtia .
 El Dinero permitirá a la sanidad pública comprar 290 aparatos de última generación para el diagnóstico y el tratamiento del cáncer.
El Dinero permitirá a la sanidad pública comprar 290 aparatos de última generación para el diagnóstico y el tratamiento del cáncer.Madrid 29 MAR 2017 .
Amancio Ortega, propietario del grupo Inditex (archivo). EFE
La fundación de Amancio Ortega, creador y máximo accionista del grupo Inditex (propietario de cadenas como Zara), ha donado 320 millones de euros para que hospitales públicos de toda España puedan comprar más de 290 equipos de última generación para el diagnóstico y tratamiento radioterápico del cáncer, según ha informado hoy la entidad.
La Fundación de Amancio Ortega —que a sus 81 años es uno de los empresarios más ricos del mundo gracias al éxito de su empresa de ropa— ya ha alcanzado principios de acuerdo con los departamentos de salud de todas las comunidades autónomas para extender el programa de apoyo a la oncología española iniciado en 2015 en Galicia que, posteriormente, amplió en mayo del año pasado a Andalucía.
Cada año se diagnostican en España más de 200.000 nuevos casos de cáncer. El 60% precisa tratamiento por radioterapia en algún momento de su evolución. Por ello, tal y como explica la fundación en una nota de prensa, "la incorporación de equipamientos de última generación, tales como la mamografía digital con tomosíntesis o los aceleradores lineales avanzados, permite realizar diagnósticos más precisos y proporcionar a los pacientes tratamientos más eficaces, menos agresivos y de menor duración".
Tras el anuncio de este miércoles, el siguiente paso será formalizar la donación mediante protocolos específicos con los diferentes Gobiernos autonómicos para dar paso a los procedimientos administrativos públicos necesarios para la adquisición de los equipos.
...
Yondelis US // Nancy McGuire - AACR Foundation // Surviving Leiomyosarcoma Thanks to Research .
 Nancy McGuire was devastated after her diagnosis but, thanks to a new chemotherapeutic, is enjoying life once again.
Nancy McGuire was devastated after her diagnosis but, thanks to a new chemotherapeutic, is enjoying life once again.After several days of pain in her lower pelvic area in December 2009, Nancy McGuire went to her primary care physician to get checked out.
Her doctor ordered several scans for the very next day, and just 17 days later, Nancy underwent surgery, not knowing exactly what the problem was. The surgery revealed that Nancy had leiomyosarcoma, a rare type of cancer.
"It was devastating. I couldn’t do anything, I came home from the hospital and stared out the window," said Nancy, a retiree from Great Falls, Virginia, who is now 70 years old. "It took me quite a while to get a grip on the fact that this was a terrible disease I had."
Following the advice of her surgeon, Nancy went to a local radiologist for radiation therapy. Nancy asked the physician how many leiomyosarcoma patients she saw each year.
"She said maybe one," Nancy recalled. "So I knew I was in deep trouble and I had to find somebody who was familiar with my disease."
Nancy’s daughter, a physician in Philadelphia, told her parents not to worry, that she would find a physician who was an expert at treating her disease, a form of soft tissue sarcoma. After Nancy’s daughter completed her research, Nancy visited an oncologist experienced in the treatment of sarcomas such as hers.
"It was the first time I felt optimistic about my future since my diagnosis," Nancy said.
Every three months, she would travel to Philadelphia for appointments. Over the next six years, she underwent many treatments, including surgery for lung nodules, microwave ablation of her liver, chemo embolization, and various chemotherapy regimens to keep the cancer at bay.
Ultimately, Nancy’s oncologist suggested a clinical trial for an investigational chemotherapeutic for soft tissue sarcomas including leiomyosarcoma. Nancy, her husband, and daughter considered her treatment options and decided to enroll in the trial of trabectedin (Yondelis).
Before she even had the chance to enroll in the trial, trabectedin received FDA approval.
"We were very excited that I would be able to take this drug after it was FDA approved," Nancy said. "After three treatments of Yondelis, a CT scan showed significant improvement. All the lesions – and I don’t even know how many there were – were significantly reduced."
Nancy continued to receive treatments and her lesions continued to shrink and, in fact, some completely went away. After a recent scan that showed continued improvement, Nancy’s physician decided to give her a break from the treatments and reevaluate her periodically to determine when best to restart the trabectedin.
"I feel wonderful emotionally and physically, it’s really good," Nancy said as she prepared for a month-long vacation in Maine. "I have learned to appreciate a lot of things in life that I never really gave enough attention to before."
Her experience with cancer has made her stop and take stock.
"It gives you more of an appreciation of life and you look at everything differently," she explained. "When your mortality is threatened, you change."
For Nancy, cancer research is vital.
"The goal of a cancer patient is to stay alive long enough to get treatment," she notes, "and the only way that is going to happen is with further research and funding to support that research."
28 marzo 2017
20,000 Leagues For Biotech to Explore . A Look at the Marine Bioprospecting Pipeline.
BioPharma DIVE // By Suzanne Elvidge .
March 27, 2017.

The sea covers around 70% of the earth, and contains around 97% of the world's water. It's also home to almost 240,000 species (that have been identified so far), from mammals and fish, down to bacteria and viruses. However, as a resource, it is still untapped.
Bioprospecting is the discovery and development of new products based on resources from the natural world. Hundreds of plant-based gargles, pills, infusions and ointments date back to Ancient Egypt. Between 1981 and 2014, around two-thirds of the small molecule drugs approved by the Food and Drug Administration were derived from or inspired by natural sources, according to the Journal of Natural Products.
...
The most recent marine-sourced drug to reach the market is Spanish company PharmaMar's Yondelis (trabectedin), launched in 2015. This cancer drug comes from an extract from a sea squirt, first found to have anticancer activity in the late 1960s.
...
A Ssnapshot of Late Stage Development:

PharmaMar
PharmaMar is a Madrid, Spain-based company with a focus on anticancer drugs from marine sources. Its first drug onto the market was Yondelis. Plitidepsin and lurbinectedin, both derived from sea squirts, are partnered with Chugai.
The plitidepsin Phase 3 trial in combination with dexamethasone in multiple myeloma will read out in the second half of 2017, and Phase 2 trials are under way in T-cell lymphoma as a monotherapy and in multiple myeloma as part of a triple therapy. Lurbinectedin is being assessed as a single agent in platinum-resistant ovarian cancer, with a readout in the second half of 2017, and other clinical trials are under way in small cell lung cancer, breast cancer and solid tumors.
...
March 27, 2017.

The sea covers around 70% of the earth, and contains around 97% of the world's water. It's also home to almost 240,000 species (that have been identified so far), from mammals and fish, down to bacteria and viruses. However, as a resource, it is still untapped.
Bioprospecting is the discovery and development of new products based on resources from the natural world. Hundreds of plant-based gargles, pills, infusions and ointments date back to Ancient Egypt. Between 1981 and 2014, around two-thirds of the small molecule drugs approved by the Food and Drug Administration were derived from or inspired by natural sources, according to the Journal of Natural Products.
...
The most recent marine-sourced drug to reach the market is Spanish company PharmaMar's Yondelis (trabectedin), launched in 2015. This cancer drug comes from an extract from a sea squirt, first found to have anticancer activity in the late 1960s.
...
A Ssnapshot of Late Stage Development:

PharmaMar
PharmaMar is a Madrid, Spain-based company with a focus on anticancer drugs from marine sources. Its first drug onto the market was Yondelis. Plitidepsin and lurbinectedin, both derived from sea squirts, are partnered with Chugai.
The plitidepsin Phase 3 trial in combination with dexamethasone in multiple myeloma will read out in the second half of 2017, and Phase 2 trials are under way in T-cell lymphoma as a monotherapy and in multiple myeloma as part of a triple therapy. Lurbinectedin is being assessed as a single agent in platinum-resistant ovarian cancer, with a readout in the second half of 2017, and other clinical trials are under way in small cell lung cancer, breast cancer and solid tumors.
...
PM01183 ( Lurbi ) . Novel Agent Active in Platinum-Resistant/Refractory Ovarian Cancer .
 Journal Oncology // Cancer Network .
Journal Oncology // Cancer Network .March 27, 2017 // By Dave Levitan .
A novel compound known as PM01183 (lurbinectedin) showed promising activity in a two-stage phase II trial of women with platinum-resistant/refractory ovarian cancer.
PM01183 is a synthetic tetrahydroisoquinoline that selectively inhibits active transcription, inducing DNA breaks and apoptosis and affecting the inflammatory microenvironment. “Strong preclinical antitumor activity was observed in cisplatin-resistant epithelial ovarian cancer models,” wrote study authors led by Andrés Poveda, MD, of the Instituto Valenciano de Oncología in Valencia, Spain.
This study included two phases: in the first exploratory stage, 22 patients with platinum-resistant/refractory ovarian cancer were treated with single-agent PM01183 at 7.0 mg every 3 weeks. The second stage was randomized, with 30 patients receiving PM01183 and 29 control patients receiving topotecan (15 crossed over to receive PM01183). The results were published in Annals of Oncology.
Among the 52 total patients treated with PM01183, there were 12 confirmed responses, including 1 complete response and 11 partial responses, for an objective response rate of 23%. The median duration of response was 4.6 months, and 23% of the responses lasted at least 6 months. The median progression-free survival (PFS) in these patients was 4.0 months, and the median overall survival (OS) was 10.6 months.
Most of the responders (75%) had an ECOG score of 0 at baseline, and most were younger than 65 years of age. Ten of the 12 (83%) had platinum-resistant disease, and two had a BRCA mutation. The objective response rate was 30% among the 33 patients with platinum-resistant disease, and the median PFS was 5.0 months.
There were no responses seen among the 29 topotecan patients. Just among the randomized patients, the median PFS was 3.9 months with PM01183 and 2.0 months with topotecan (P = .0067); OS was no different, at 9.7 months with the study drug and 8.5 months with topotecan (P = .2871).
Myelosuppression was the most common adverse event seen with PM01183. Grade 3/4 neutropenia occurred in 85% of PM01183 patients (64% with grade 4), and grade 3/4 thrombocytopenia occurred in 33%. Fatigue of any grade occurred in 77% of PM01183-treated patients, and was the most common nonhematologic toxicity. There was 1 patient with grade 3 rhabdomyolysis that was related to treatment. No treatment-related deaths occurred in the study.
“PM01183 is an active drug in platinum-resistant/refractory ovarian cancer and warrants further clinical development, particularly in platinum-resistant disease, where its activity was remarkable,” the authors concluded. The drug is now being tested in the phase III CORAIL trial, which includes patients with platinum-resistant ovarian cancer.
Instituto Oncológico Baselga inaugura un nuevo centro en Hospital El Pilar .
 Barcelona, 27 mar (EFE).
Barcelona, 27 mar (EFE).El Instituto Oncológico Baselga (IOB) ha informado hoy de la puesta en marcha de su actividad como nuevo centro de oncología perteneciente al Hospital El Pilar de Barcelona, del grupo Quirónsalud.
Según un comunicado emitido por el Instituto, el IOB, formado por un grupo de oncólogos reconocidos a nivel mundial, trabajará de forma coordinada con los equipos médicos del Hospital El Pilar, liderados por su director médico, el doctor José Antonio Neguillo.
A través de este acuerdo, el Instituto introducirá en el Hospital El Pilar su visión integral del cáncer y un completo equipo médico encabezado por el director médico del Instituto Oncológico Baselga del Hospital Quirón de Barcelona, el doctor Josep Tabernero, y el director del IOB en Madrid, el doctor Javier Cortés.
La unidad de oncología del IOB en el Hospital El Pilar estará liderada por los doctores José Manuel Pérez, Jesús Soberino y Cristina Urbano.
Esta operación se enmarca en el proceso de renovación y modernización general del Hospital El Pilar emprendido en los últimos años y que contempla la introducción continua de mejoras con el fin de consolidar este centro como un referente de la sanidad privada.
27 marzo 2017
Más de 15.000 Personas Corren en Madrid Contra el Cáncer .
 El Presidente de AECC, Ignacio Muñoz, ha asegurado que la carrera es “un espaldarazo” para todos aquellos que sufren la enfermedad .
El Presidente de AECC, Ignacio Muñoz, ha asegurado que la carrera es “un espaldarazo” para todos aquellos que sufren la enfermedad .Cada año la mortalidad mundial por esta enfermedad desciende un 1% gracias a la investigación .
 Más de 15.000 personas, según el Ayuntamiento de Madrid, han participado hoy en la Carrera anual contra el Cáncer para transmitir un mensaje de esperanza y energía y recordar a los que han fallecido a causa de ella, como la modelo y cantante Bimba Bosé, el pasado 23 de enero.
Más de 15.000 personas, según el Ayuntamiento de Madrid, han participado hoy en la Carrera anual contra el Cáncer para transmitir un mensaje de esperanza y energía y recordar a los que han fallecido a causa de ella, como la modelo y cantante Bimba Bosé, el pasado 23 de enero."Es un espaldarazo para todos los que están luchando contra la enfermedad, para que sepan que todo Madrid está con ellos", ha dicho a EFE TV el presidente de la Asociación Española Contra el Cáncer (AECC), Ignacio Muñoz, quien ha destacado que el 50 % de los casos se pueden prevenir con ejercicio y vida saludable.
Ha explicado que una parte de la recaudación de la carrera será para ayudar a los enfermos y otra se dedicará a investigación de la enfermedad, cuya mortalidad desciende un 1 % cada año en el mundo.
La ayuda profesional de la asociación llega a 50.000 personas; la de los voluntarios, a medio millón en hospitales y domicilios; y la prevención, a cerca de un millón.
"Es impresionante la energía de la gente, la vida y la solidaridad que se siente", ha enfatizado, a su vez, Lucía Bosé, madre de Bimba. “Me he sentido orgullosísima como madre”, ha confesado.
La primera teniente de alcalde, Marta Higueras, ha considerado un "orgullo" que el Ayuntamiento facilite y dé todo el apoyo institucional.
Según la responsable municipal, hay esperanza y esta carrera es la muestra de que se sale del cáncer.
El exjugador de baloncesto Fernando Romay ha valorado el trabajo de la AECC y el esfuerzo de los corredores, más aun al haberse adelantado anoche la hora.
El ganador, Juan Carlos de la Ossa, ha destacado que la carrera haya transcurrido con una "animación espectacular" y en el Paseo de la Castellana, una de las vías más importantes de la ciudad.
26 marzo 2017
PharmaMar Saca Pecho con el Mayor Esfuerzo Inversor en Investigación : Más de 90 Millones de euros en este 2017. Si las cosas salen bien, Disparará las Ventas de la Compañía por Encima de los 1.000 Millones de euros.
1.200 Patentes y 20 Moléculas en distintas Fases de Desarrollo Clínico y Preclínico en los Laboratorios de Pharmamar en Colmenar Viejo (Madrid) .
Es la Firma del Mercado Español que más puede Subir en los Próximos doce meses. El consenso de mercado que recoge Fact Set marca su precio objetivo en los 4,952 euros por título; es decir, un 82 % más que su cotización actual.
M. SÍO // VIGO / LA VOZ 26/03/2017 .
Yondelis es solo el principio. Tras el éxito de este medicamento para sarcoma de tejidos blandos -un tipo muy específico de cáncer- que ya se comercializa en 83 países, incluidos EE. UU. y Japón, Pharmamar va a por todas para ampliar su cartera de antitumorales de origen marino con tres nuevos fármacos en un plazo no superior a tres años.El reto es ambicioso, sobre todo para una compañía de muy bajo valor en bolsa en estos momentos (2,9 euros por acción) y bajo permanente amenaza de una oferta pública de adquisición (opa). Pero, lejos de amilanarse, el grupo de origen gallego saca pecho con el mayor esfuerzo inversor en investigación: más de 90 millones de euros en este 2017. Si las cosas salen bien, disparará las ventas de la compañía por encima de los 1.000 millones de euros.

Las más Grandes Expectativas de Futuro están puestas en la Molécula PM1183 para el Tratamiento del Cáncer de Ovario, que pretende entrar en el Mercado de EEUU por la Puerta Grande de la mano de una Biofarmacéutica Norteamericana con la que ya estarían en Conversaciones Muy Avanzadas.
El año pasado, el grupo registró 24 millones de pérdidas, principalmente por la fuerte inversiones en I+D y la finalización del acuerdo de licencia con la farmacéutica Janssen.
De cara a este ejercicio, la firma espera una vuelta a los beneficios, hasta los 7,4 millones.
Una cantidad que se multiplicaría por 3,2 veces de cara al año siguiente.
1.200 patentes .
Con poco más de 600 millones de capitalización, la compañía que preside José María Fernández Sousa se ha convertido, a juicio de los analistas, en la firma del mercado español que más puede subir en los próximos doce meses. El consenso de mercado que recoge Fact Set marca su precio objetivo en los 4,952 euros por título; es decir, un 82 % más que su cotización actual.
El producto estrella del grupo es Yondelis, el primer medicamento de origen marino aprobado en Europa que se utiliza para el tratamiento del sarcoma y el cáncer de ovarios.
Pero la idea es que para el 2020 ya haya en el mercado tres compuestos para cinco o más indicaciones de diferentes tipos de cáncer: Yondelis, Aplidin y PM1183.
Con 76 años de historia en el sector, el grupo que encabeza Fernández Sousa (fundado en Vigo, en donde sigue la sede de su división química Zelnova Zeltia) es hoy una multinacional enfocada fundamentalmente a la biotecnología, que desarrolla y comercializa fármacos a partir de moléculas extraídas del fondo de los océanos para el tratamiento de enfermedades oncológicas.
El resultado de este trabajo se traduce en más de 1.200 patentes y 20 moléculas en distintas fases de desarrollo clínico y preclínico en los laboratorios de Pharmamar en Colmenar Viejo (Madrid) con muchas posibilidades de seguir el camino iniciado por Yondelis, Aplidin, PM1183 y la prometedora PM1184.
NeoVax . Catherine Wu impulsa un nuevo tratamiento personalizado que se está probando en personas con tumores de cerebro y melanoma .
 NUÑO DOMÍNGUEZ // Boston 24 MAR 2017 .
NUÑO DOMÍNGUEZ // Boston 24 MAR 2017 .Katherine Wu, investigadora del Instituto de Cáncer Dana-Farber, en Boston (EE UU). DANA-FARBER .
“Ninguna persona responde al cáncer igual que otra”, dice la oncóloga y hematóloga Catherine Wu. Durante años, esta investigadora ha estudiado la respuesta de sus pacientes al trasplante de médula ósea para tratar sus leucemias. “Si te preguntas por qué algunos se curaron”, explica, “entiendes que es una reacción compleja que involucra a todas las ramas del sistema inmune, así que probablemente un tratamiento homogéneo, una especie de talla única para todos los pacientes, no va a funcionar”, asegura Wu en su despacho del Centro de Cáncer Dana-Farber, en Boston (EE UU).
La mujer que desarrolla la vacuna contra el cáncer El azar es la principal causa del cáncer
Wu está aplicando esa idea al desarrollo de una vacuna contra el cáncer o, mejor dicho, muchas vacunas contra muchos cánceres, tantas como pacientes. La nueva generación de fármacos de inmunoterapia se basan en espabilar al sistema inmune para que aprenda a identificar y eliminar las células tumorales. Wu busca la forma de que esa respuesta sea mucho más específica y que además funcione en todas las personas, no solo en una fracción de ellas, como sucede ahora.
“La gente ha trabajado en las vacunas del cáncer durante décadas, se ha puesto mucho esfuerzo y ha habido muy buenas ideas, pero no muchos resultados”, reconoce Wu. Dos avances recientes han devuelto la esperanza a este campo de investigación. El primero es la mejora de la tecnología para secuenciar el genoma completo del tumor de cada paciente, con lo que se conoce al detalle el perfil genético específico de su cáncer. También han mejorado mucho los algoritmos que predicen cómo una proteína concreta se unirá a la superficie de una célula, de forma que el sistema inmune pueda verla.
Hace cuatro años, Wu probó a tratar a pacientes con leucemia crónica con células tumorales desactivadas. Esa autovacuna reforzó la respuesta inmunitaria y ayudó a algunos pacientes a controlar el tumor. La nueva vacuna de Wu es una versión refinada que lleva solo “los ingredientes activos”, conocidos como neoantígenos “Son [proteínas] muy específicas del tumor y no se encuentran en tejidos normales, así que, de repente, tenemos una forma de identificarlos y podemos usar nuestra creatividad para ver cómo vamos a atacar a esos antígenos”, explica Wu. El problema es que los neoantígenos son muy diferentes de paciente a paciente, por lo que hay que hacer un tratamiento específico para cada uno.
La nueva vacuna, NeoVax, tiene dos componentes. El primero son péptidos desarrollados en base a los neoantígenos del tumor. Esos péptidos muestran los antígenos a las células del sistema inmune y estas aprenden a identificarlos y eliminar las células que los llevan en su superficie. El segundo componente es una secuencia de ARN que aumenta la respuesta inmune
...
24 marzo 2017
Small Cell Lung Cancer (SCLC ): No Treatment Advances in Recent Years .
Small cell lung cancer (SCLC) is an aggressive malignancy with a distinct natural history and dismal prognosis. Given its predisposition for early dissemination, patients are commonly diagnosed with metastatic disease and chemotherapy is regarded as the cornerstone of approved treatment strategies.
However, over the last 30 years there has been a distinct paucity of significant breakthroughs in SCLC therapy. Thus, SCLC is characterized as a recalcitrant neoplasm with limited therapeutic options. By employing well-established research approaches, proven to be efficacious in non-small cell lung cancer (NSCLC), a growing amount of data has shed light on the molecular biology of SCLC and enhanced our knowledge of the “drivers” of tumor cell survival and proliferation.
New therapeutic targets have emerged, but no significant improvement in patients’ survival has been demonstrated thus far.
In a sense, the more we know, the more we fail.
Nowadays this is starting to change and methodical research efforts are underway. It is anticipated that the next decade will see a revolution in the treatment of SCLC patients with the application of effective precision medicine and immunotherapy strategies.
...
Conclusions :
In spite of recent advances in elucidating the aberrant molecular pathways that dictate SCLC oncogenesis, this malignancy remains an important public health problem, leading to the death of approximately 16,000 patients per year in the United States (14). For decades, cytotoxic chemotherapy has remained the backbone of treatment but, while SCLC is a chemo-sensitive disease, experience shows that high response rates are not universally translated into a cure. Nevertheless, it is high time progress was made in SCLC research and we have all the necessary tools at our disposal. Every failure is a lesson learnt, every success a battle fought. Our aim must be to improve the prognosis of patients with SCLC.
We are still on the long journey to Ithaca and should not let the Sirens of excessive optimism distract us from our goal. With determination and cunning we can reach Ithaca. By any means, whatever the final result may be, the entire research process will make us wiser.
“As you set out for Ithaca, hope the voyage is a long one, full of adventure, full of discovery……And if you find her poor, Ithaca won’t have fooled you. Wise as you will have become, so full of experience, you will have understood by then what these Ithakas mean” (The Canon by CP Cavafy, translated by Edmund Keeley and Philip Sherrard).
...
*********************
However, over the last 30 years there has been a distinct paucity of significant breakthroughs in SCLC therapy. Thus, SCLC is characterized as a recalcitrant neoplasm with limited therapeutic options. By employing well-established research approaches, proven to be efficacious in non-small cell lung cancer (NSCLC), a growing amount of data has shed light on the molecular biology of SCLC and enhanced our knowledge of the “drivers” of tumor cell survival and proliferation.
New therapeutic targets have emerged, but no significant improvement in patients’ survival has been demonstrated thus far.
In a sense, the more we know, the more we fail.
Nowadays this is starting to change and methodical research efforts are underway. It is anticipated that the next decade will see a revolution in the treatment of SCLC patients with the application of effective precision medicine and immunotherapy strategies.
...
Conclusions :
In spite of recent advances in elucidating the aberrant molecular pathways that dictate SCLC oncogenesis, this malignancy remains an important public health problem, leading to the death of approximately 16,000 patients per year in the United States (14). For decades, cytotoxic chemotherapy has remained the backbone of treatment but, while SCLC is a chemo-sensitive disease, experience shows that high response rates are not universally translated into a cure. Nevertheless, it is high time progress was made in SCLC research and we have all the necessary tools at our disposal. Every failure is a lesson learnt, every success a battle fought. Our aim must be to improve the prognosis of patients with SCLC.
We are still on the long journey to Ithaca and should not let the Sirens of excessive optimism distract us from our goal. With determination and cunning we can reach Ithaca. By any means, whatever the final result may be, the entire research process will make us wiser.
“As you set out for Ithaca, hope the voyage is a long one, full of adventure, full of discovery……And if you find her poor, Ithaca won’t have fooled you. Wise as you will have become, so full of experience, you will have understood by then what these Ithakas mean” (The Canon by CP Cavafy, translated by Edmund Keeley and Philip Sherrard).
...
*********************
P.J.: Según los Analistas de EDISON Investment ... Uno de los Farmacos más relevantes de los últimos 30 años en la I+D para el Tratamiento de SCLC es el PM01183 ( Lurbi ) . Dichos Analistas Destacan en el reciente Analisis publicado la semana pasada que PM01183 es Orphan Drug tanto en Ovario como en SCLC asi como todas las Protecciones que tiene el Farmaco hasta el 2033 :
*********************************************
PharmaMar . Del 1 al 5 de abril Presentara Nuevos Datos de Yondelis , Aplidin y PM01183 ( LURBI ) en el Congreso Anual de la AACR .
 Congreso Anual de la AACR del del 1 al 5 de abril de 2017 que se realiza en Washington DC.
Congreso Anual de la AACR del del 1 al 5 de abril de 2017 que se realiza en Washington DC. Este Congreso de la “American Association for Cancer Research” (AACR) es un importante foro internacional donde se presentan los últimos avances en terapias dirigidas contra el cáncer y nuevas estrategias terapéuticas.
El Congreso de la AACR es todo un referente mundial en el ámbito de la investigación sobre el cáncer.
AACR es la Mayor Organización Científica del Mundo en Oncología.
Aplidin Combinado con Gemzar ® (Gemcitabine) de Lilly . Resultados de la Fase I Lymphomas .
Aspeslagh S, Stein M, Bahleda R, Hollebecque A, Salles G, Gyan E, Fudio S, Extremera S, Alfaro V, Soto-Matos A, Soria JC.
Abstract :
This phase I trial evaluated the combination of the marine-derived cyclodepsipeptide plitidepsin (trade name Aplidin) with sorafenib or gemcitabine in advanced cancer and lymphoma patients. The study included two treatment arms: a sorafenib/plitidepsin (S/P) and a gemcitabine/plitidepsin (G/P) arm. In the S/P arm, patients were treated orally with sorafenib continuous dosing at two dose levels (DL1: 200 mg twice daily and DL2: 400 mg twice daily) combined with plitidepsin (1.8 mg/m, day 1, day 8, day 15, and, q4wk, intravenously).
In the G/P arm, patients with solid tumors or lymphoma were treated at four different DLs with a combination of gemcitabine (DL1: 750 mg/m, DL2-DL4: 1000 mg/m) and plitidepsin (DL1-DL2: 1.8 mg/m; DL3: 2.4 mg/m; DL4: 3 mg/m). Both agents were administered intravenously on day 1, day 8, day 15, and, q4wk. Forty-four patients were evaluable for safety and toxicity. The safety of the combination of plitidepsin with sorafenib or gemcitabine was manageable.
Most adverse events (AEs) were mild; no grade 4 treatment-related AEs were reported in any of the groups (except for one grade 4 thrombocytopenia in the gemcitabine arm). The most frequently reported study drug-related (or of unknown relationship) AEs were palmar-plantar erythrodysesthesia, erythema, nausea, vomiting, and fatigue in the S/P arm and nausea, fatigue, and vomiting in the G/P arm. In the S/P arm, one dose-limiting toxicity occurred in two out of six patients treated at the maximum dose tested (DL2): palmar-plantar erythrodysesthesia and grade 2 aspartate aminotransferase/alanine aminotransferase increase that resulted in omission of days 8 and 15 plitidepsin infusions.
In the G/P arm, one dose-limiting toxicity occurred in two out of six patients at DL4: grade 2 alanine aminotransferase increase resulted in omission of days 8 and 15 plitidepsin infusions and grade 4 thrombocytopenia.
The recommended dose for the combination of plitidepsin with sorafenib was not defined because of a sponsor decision (no expansion cohort to confirm) and for plitidepsin with gemcitabine, it was 2.4 mg/m plitidepsin with 1000 mg/m gemcitabine. In the S/P group, objective disease responses were not observed; however, disease stabilization (≥3months) was observed in four patients.
In the Gemcitabine Group, two Lymphoma Patients Showed an Objective Response ( Partial Response and Complete Response ) and Nine Patients showed Disease Stabilization (≥3months). Combining plitidepsin with Gemcitabine and Sorafenib is feasible for advanced cancer patients; some objective responses were observed in heavily pretreated lymphoma patients.
#HorizonteAntártida : La Aventura de la Ciencia . Distantcom : Los Alegres buceadores del bentos antártico .
Publicado por: 23 marzo, 2017 .
Especial para Efeverde, por @ValentinCarrera a bordo del Hespérides.-
 “Si nos cargamos la biodiversidad, nos cargamos también moléculas no descritas, potencialmente beneficiosas”, me explica Conxita Ávila, mientras inspecciona uno de sus botes de muestras, de espaldas a la cámara para no salir en las fotografías, de modo que retrato a otros miembros de su equipo, miembras diría aquí la ilustre exministra, porque es el único equipo fifty fifty chicos-chicas, y el único de los casi treinta proyectos de esta campaña dirigido por una mujer.
“Si nos cargamos la biodiversidad, nos cargamos también moléculas no descritas, potencialmente beneficiosas”, me explica Conxita Ávila, mientras inspecciona uno de sus botes de muestras, de espaldas a la cámara para no salir en las fotografías, de modo que retrato a otros miembros de su equipo, miembras diría aquí la ilustre exministra, porque es el único equipo fifty fifty chicos-chicas, y el único de los casi treinta proyectos de esta campaña dirigido por una mujer.
Cuando hablamos de igualdad, significa que la paridad rompa el techo de cristal y alcance los puestos de mando: una mujer (o dos si incluimos a la colombiana Rosa Acevedo) entre treinta IPs, investigadores principales, no es para echar cohetes. Queda dicho.
Había oído hablar de Conxita Ávila bastante antes de conocerla: cuando llegó, en enero, le precedía una fama contundente. El runrún que los periodistas estamos obligados a sintonizar traducía ecos de una mujer de carácter fuerte y muy catalana, dos virtudes que levantan ampollas en un mundo masculino y con sello estatal.
Pero la ciencia no tiene fronteras, como demuestra el proyecto DISTANTCOM que lidera Conxita Ávila en esta campaña, su novena en la Antártida, con investigadores de la Universidad de Barcelona. Uno de los equipos más jóvenes y dinámicos, y añadiré por mi cuenta alegres y divertidos, formado por Carlos Angulo, Rafael Martín, Joana Vicente, Blanca Figuerola, Joan Giménez, Elisenda Ballesté y Conxita Ávila. Biólogos y oceanógrafos enamorados del misterioso fondo submarino.
En ese fondo que los mortales solo podemos conocer a través de sus fotos y vídeos, habita todo un mundo vegetal y animal, infinitas comunidades de algas, erizos, estrellas, esponjas, corales, briozoos, moluscos: todos estos organismos forman el bentos, no tan popular como los pingüinos y las focas, pero imprescindible para la vida oceánica: el bentos es un eslabón clave en la cadena trófica, de modo que sin ese secreto conglomerado vegetal y animal, no habría krill ni pingüinos ni ballenas.
Durante su estancia en Isla Decepción, arropados por el trabajo formidable de los soldados de la Base Gabriel de Castilla, las buceadoras y buceadores de DISTANTCOM se sumergen cada día a 20 ó 25 metros de profundidad, con temperaturas de 0º a -2º, para tomar muestras de ese bentos marino, que inmediatamente son trasladadas para su estudio, en vivo, en el laboratorio húmedo instalado en la propia Base. El laboratorio helado, a temperatura ambiente, donde converso con Conxita Ávila, y donde Joan y Blanca me muestran sus experimentos con líquidos de colorines.
Tenemos cuatro líneas de investigación —explica la doctora Ávila— :
1) Ecología química, extraer productos naturales, estudiar su papel ecológico y su posible aplicación farmacológica, que puede derivar en alguna futura patente;
2) Biodiversidad y efectos del cambio climático en estas comunidades bentónicas;
3) Evolución y filogeografía: contribuir al mejor conocimiento de la distribución de las distintas especies;
4) Ecología trófica, cómo funciona la cadena alimenticia.
...

Especial para Efeverde, por @ValentinCarrera a bordo del Hespérides.-
 “Si nos cargamos la biodiversidad, nos cargamos también moléculas no descritas, potencialmente beneficiosas”, me explica Conxita Ávila, mientras inspecciona uno de sus botes de muestras, de espaldas a la cámara para no salir en las fotografías, de modo que retrato a otros miembros de su equipo, miembras diría aquí la ilustre exministra, porque es el único equipo fifty fifty chicos-chicas, y el único de los casi treinta proyectos de esta campaña dirigido por una mujer.
“Si nos cargamos la biodiversidad, nos cargamos también moléculas no descritas, potencialmente beneficiosas”, me explica Conxita Ávila, mientras inspecciona uno de sus botes de muestras, de espaldas a la cámara para no salir en las fotografías, de modo que retrato a otros miembros de su equipo, miembras diría aquí la ilustre exministra, porque es el único equipo fifty fifty chicos-chicas, y el único de los casi treinta proyectos de esta campaña dirigido por una mujer.Cuando hablamos de igualdad, significa que la paridad rompa el techo de cristal y alcance los puestos de mando: una mujer (o dos si incluimos a la colombiana Rosa Acevedo) entre treinta IPs, investigadores principales, no es para echar cohetes. Queda dicho.
Había oído hablar de Conxita Ávila bastante antes de conocerla: cuando llegó, en enero, le precedía una fama contundente. El runrún que los periodistas estamos obligados a sintonizar traducía ecos de una mujer de carácter fuerte y muy catalana, dos virtudes que levantan ampollas en un mundo masculino y con sello estatal.
Pero la ciencia no tiene fronteras, como demuestra el proyecto DISTANTCOM que lidera Conxita Ávila en esta campaña, su novena en la Antártida, con investigadores de la Universidad de Barcelona. Uno de los equipos más jóvenes y dinámicos, y añadiré por mi cuenta alegres y divertidos, formado por Carlos Angulo, Rafael Martín, Joana Vicente, Blanca Figuerola, Joan Giménez, Elisenda Ballesté y Conxita Ávila. Biólogos y oceanógrafos enamorados del misterioso fondo submarino.
En ese fondo que los mortales solo podemos conocer a través de sus fotos y vídeos, habita todo un mundo vegetal y animal, infinitas comunidades de algas, erizos, estrellas, esponjas, corales, briozoos, moluscos: todos estos organismos forman el bentos, no tan popular como los pingüinos y las focas, pero imprescindible para la vida oceánica: el bentos es un eslabón clave en la cadena trófica, de modo que sin ese secreto conglomerado vegetal y animal, no habría krill ni pingüinos ni ballenas.
Durante su estancia en Isla Decepción, arropados por el trabajo formidable de los soldados de la Base Gabriel de Castilla, las buceadoras y buceadores de DISTANTCOM se sumergen cada día a 20 ó 25 metros de profundidad, con temperaturas de 0º a -2º, para tomar muestras de ese bentos marino, que inmediatamente son trasladadas para su estudio, en vivo, en el laboratorio húmedo instalado en la propia Base. El laboratorio helado, a temperatura ambiente, donde converso con Conxita Ávila, y donde Joan y Blanca me muestran sus experimentos con líquidos de colorines.
Tenemos cuatro líneas de investigación —explica la doctora Ávila— :
1) Ecología química, extraer productos naturales, estudiar su papel ecológico y su posible aplicación farmacológica, que puede derivar en alguna futura patente;
2) Biodiversidad y efectos del cambio climático en estas comunidades bentónicas;
3) Evolución y filogeografía: contribuir al mejor conocimiento de la distribución de las distintas especies;
4) Ecología trófica, cómo funciona la cadena alimenticia.
...

Azar ... La Principal Causa del Cáncer .
 Dos tercios de los cánceres no pueden prevenirse con el estilo de vida; la detección precoz es más esencial que nunca .
Dos tercios de los cánceres no pueden prevenirse con el estilo de vida; la detección precoz es más esencial que nunca .
JAVIER SAMPEDRO /// Madrid 23 MAR 2017 .
Tradicionalmente se ha pensado que las mutaciones que causan el cáncer provienen de dos fuentes principales: la herencia y el ambiente (humo del tabaco, radiación ultravioleta de la luz solar y muchas otras). Un macroestudio coordinado por genetistas de la Johns Hopkins confirma ahora que no es así: dos tercios de las mutaciones cancerosas provienen de errores al azar en el proceso de replicación del ADN. Solo el tercio restante se debe a la herencia y al ambiente. Este hecho tiene importantes consecuencias para la prevención y tratamiento precoz de cada tipo de cáncer.
El mismo consorcio que publica estos resultados en Science, coordinado por Cristian Tomasetti y Bert Vogelstein, de la facultad de medicina pública Bloomberg de la Universidad Johns Hopkins en Baltimore (un nodo de la genómica internacional del cáncer), ya presentó hace dos años unas conclusiones similares. El megaproyecto ha obtenido ahora evidencias nuevas que las refuerzan, y que revelan nuevas claves que serán valiosas para los oncólogos que tratan a pacientes. Se basan en un nuevo modelo matemático y en datos epidemiológicos de medio planeta.
El trabajo no implica que haya que bajar la guardia sobre los factores ambientales cancerígenos. “Es bien sabido”, explica Tomasetti, “que debemos evitar factores ambientales como fumar para reducir el riesgo de cáncer; pero es menos conocido que, cada vez que una célula normal se divide y duplica su ADN para generar dos células nuevas, comete múltiples errores”. El genoma humano tiene 3.000 millones de bases (las letras del ADN gatacca…) y, pese a que la fidelidad del sistema de replicación es muy alta (menor a un error en un millón), queda mucho margen para generar mutaciones aleatorias.
...
23 marzo 2017
Genomica SAU . Suministro de reactivos y material fungible para la detección del VPH .
Expediente B2017/002703 KITS DETERMINACIÓN VPH .
 Estado de la licitación: Adjudicada
Estado de la licitación: Adjudicada
Organismo que lo promueve: Consejería de Sanidad
Descripción:
Suministro de reactivos y material fungible para la detección del VPH (1584 determinaciones) de los tipos de alto riesgo oncogénico, con genotipado individual y diferenciado de los mismos, así como el mantenimiento de equipos por un periodo de 15 días.
Código de expediente: B2017/002703
Tipo de contrato: Suministros
Tipo de tramitación: Ordinaria
Procedimiento de contratación: Contrato menor
Importe máximo estimado sin IVA: 17990,00 euros
CPV: 33694000-1
Inicio de la publicación: 22 de marzo de 2017, 13:10
Última actualización: 22 de marzo de 2017, 13:10 .
Número de invitaciones: 1
Número de ofertas: 1
Aprobación del gasto:
Fecha de aprobación: 22 de marzo de 2017
Importe de la oferta seleccionada sin IVA: 17989,20 euros .
Adjudicatario: GENOMICA S.A.U
 Estado de la licitación: Adjudicada
Estado de la licitación: AdjudicadaOrganismo que lo promueve: Consejería de Sanidad
Descripción:
Suministro de reactivos y material fungible para la detección del VPH (1584 determinaciones) de los tipos de alto riesgo oncogénico, con genotipado individual y diferenciado de los mismos, así como el mantenimiento de equipos por un periodo de 15 días.
Código de expediente: B2017/002703
Tipo de contrato: Suministros
Tipo de tramitación: Ordinaria
Procedimiento de contratación: Contrato menor
Importe máximo estimado sin IVA: 17990,00 euros
CPV: 33694000-1
Inicio de la publicación: 22 de marzo de 2017, 13:10
Última actualización: 22 de marzo de 2017, 13:10 .
Número de invitaciones: 1
Número de ofertas: 1
Aprobación del gasto:
Fecha de aprobación: 22 de marzo de 2017
Importe de la oferta seleccionada sin IVA: 17989,20 euros .
Adjudicatario: GENOMICA S.A.U
Situación de la I+D farmacéutica en España .
 Pharma Market , 21 Marzo 2017 .
Pharma Market , 21 Marzo 2017 .La industria farmacéutica es uno de los sectores más innovadores, caracterizado por utilizar una tecnología de producción avanzada y realizar una investigación de calidad con personal altamente cualificado.
Según el informe “Estadística sobre Actividades de I+D 2015” del INE, el gasto en I+D creció en 2015 un 2,7% respecto a 2014, lo que supuso el 1,22% del PIB, concentrando la industria farmacéutica el 8,6% del gasto total en dicho año.
Según los últimos datos disponibles, el 79,5% de las empresas farmacéuticas realizó actuaciones innovadoras en el periodo 2013-2015, por lo que la industria farmacéutica se encuentra en un puesto privilegiado en el ranking de “porcentaje de empresas con actividades innovadoras”.
La industria farmacéutica española es intensiva en I+D+i, lo que la sitúa en una posición clave para contribuir al crecimiento futuro de la economía en su conjunto, dadas sus características propias como motor de desarrollo.
Según los últimos datos de la Federación de Asociaciones de la Industria Farmacéutica Europea (EFPIA), España tiene cada vez una mayor importancia en materia farmacéutica dentro del entorno europeo, consolidándose como el sexto mercado más importante del continente en generación de empleo (tras Alemania, Francia, Reino Unido, Italia y Suiza), el quinto más importante en volumen de ventas (tras Alemania, Francia, Italia y Reino Unido), y el séptimo mercado de la Unión Europea en términos de producción (tras Suiza, Alemania, Italia, Francia, Irlanda y Reino Unido).
Ya existe una prueba para calcular el riesgo de Alzheimer's .
 De acuerdo a investigadores de San Diego y San Francisco .
De acuerdo a investigadores de San Diego y San Francisco .22 de Marzo 2017
Los investigadores de la Facultad de Medicina de la Universidad de California en San Diego (UCSD) y de la Universidad de California en San Francisco (UCSF) han creado una prueba genética que puede calcular el riesgo específico de un paciente Del Alzheimer.
El método busca 31 marcadores genéticos, recolectados de más de 70.000 individuos, incluyendo pacientes que padecen Alzheimer, así como pacientes ancianos sanos.
"Prevenir el desarrollo de los síntomas de la demencia es el santo grial de la investigación de Alzheimer, pero para tener éxito primero necesitamos métodos precisos para predecir quién tiene más probabilidades de desarrollar la enfermedad” dijo James Pickett, jefe de investigación de la Alzheimer's Society en un informe publicado por The Guardian.
Cabe señalar que la puntuación alta en esta prueba genética no significa automáticamente que alguien va a desarrollar Alzheimer. Tampoco implica que el puntaje bajo significa que alguien sería considerado inmune a la enfermedad. La genética es uno de los varios factores que determinan el riesgo de una persona para desarrollar cualquier enfermedad, incluyendo Alzheimer.
"Desde una perspectiva clínica, el [examen] proporciona una novedosa manera no sólo para evaluar el riesgo de desarrollar la enfermedad de Alzheimer, sino también para predecir la edad de inicio de la enfermedad", dijo el autor principal, Anders Dale, de la Facultad de Medicina de la Universidad de California de San Diego.
EEUU investiga 9 muertes por un tumor asociado a prótesis mamarias .
Redacción | A Coruña 23.03.2017 .
La Federación estadounidense de Alimentos y Fármacos (FDA) ha informado de la muerte de nueve mujeres a causa de un tipo de cáncer que se vincula con la implantación de prótesis mamarias. Todas las víctimas sufrieron un linfoma anaplástico de células grandes que afecta al sistema inmune y aparece en la piel y los ganglios linfáticos, según informó la CNN, donde aseguran que las autoridades sanitarias de Estados Unidos investigan todavía lo sucedido.
Desde la FDA reconocen que el riesgo de sufrir este tipo de tumores es bajo, pero que aumenta en quienes se han implantado prótesis mamarias. Desde 2011 este organismo realiza un seguimiento de los casos para ver posibles complicaciones. Desde entonces se recibieron 359 informes de pacientes con este tipo de linfoma, de ellas nueve muertes y todas las víctimas se habían implantado prótesis de mama para aumentar su pecho.
La Federación estadounidense de Alimentos y Fármacos (FDA) ha informado de la muerte de nueve mujeres a causa de un tipo de cáncer que se vincula con la implantación de prótesis mamarias. Todas las víctimas sufrieron un linfoma anaplástico de células grandes que afecta al sistema inmune y aparece en la piel y los ganglios linfáticos, según informó la CNN, donde aseguran que las autoridades sanitarias de Estados Unidos investigan todavía lo sucedido.
Desde la FDA reconocen que el riesgo de sufrir este tipo de tumores es bajo, pero que aumenta en quienes se han implantado prótesis mamarias. Desde 2011 este organismo realiza un seguimiento de los casos para ver posibles complicaciones. Desde entonces se recibieron 359 informes de pacientes con este tipo de linfoma, de ellas nueve muertes y todas las víctimas se habían implantado prótesis de mama para aumentar su pecho.
21 marzo 2017
CNIO and PharmaMar Have Signed a Collaboration Agreement to Identify New Anti-Tumour Therapies from The Marine Environment.
CNIO y PharmaMar han Rubricado un Acuerdo de Colaboración para Comenzar a Realizar Nuevos Ensayos de Cribado para Caracterizar el Potencial Antitumoral de Compuestos de Origen Marino.

PHARMA MARKET , 21 Marzo 2017 .

La firma se ha realizado en la sede del CNIO, y ha contado con la presencia de la doctora María A. Blasco, directora del CNIO; Carmen Vela Olmo, secretaria de Estado de Investigación, Desarrollo e Innovación y Presidenta del Patronato del CNIO; y José María Fernández Sousa-Faro, Presidente de PharmaMar.

El acuerdo contempla que el CNIO proporcionará el conocimiento y las herramientas desarrollados por distintos grupos de investigación del Centro, en particular el Programa de Terapias Experimentales, que tiene por objetivo el descubrimiento temprano de fármacos que identifiquen nuevos agentes terapéuticos para el tratamiento del cáncer.
Además, se realizarán estudios basados en el uso de modelos celulares procedentes de distintos tumores así como la plataforma de células madre tumorales del CNIO. Con especial ahínco se estudiará el cribado fenotípico y la modulación de dianas terapéuticas ya identificadas por el CNIO.
 Por su parte, PharmaMar proporcionará al CNIO tanto el acceso, como los datos y material científico, de los compuestos puros y de la biblioteca de organismos marinos para trabajar conjuntamente en la detección de nuevas dianas terapéuticas frente a diferentes tipos de tumores.
Por su parte, PharmaMar proporcionará al CNIO tanto el acceso, como los datos y material científico, de los compuestos puros y de la biblioteca de organismos marinos para trabajar conjuntamente en la detección de nuevas dianas terapéuticas frente a diferentes tipos de tumores.

PHARMA MARKET , 21 Marzo 2017 .

La firma se ha realizado en la sede del CNIO, y ha contado con la presencia de la doctora María A. Blasco, directora del CNIO; Carmen Vela Olmo, secretaria de Estado de Investigación, Desarrollo e Innovación y Presidenta del Patronato del CNIO; y José María Fernández Sousa-Faro, Presidente de PharmaMar.

El acuerdo contempla que el CNIO proporcionará el conocimiento y las herramientas desarrollados por distintos grupos de investigación del Centro, en particular el Programa de Terapias Experimentales, que tiene por objetivo el descubrimiento temprano de fármacos que identifiquen nuevos agentes terapéuticos para el tratamiento del cáncer.
Además, se realizarán estudios basados en el uso de modelos celulares procedentes de distintos tumores así como la plataforma de células madre tumorales del CNIO. Con especial ahínco se estudiará el cribado fenotípico y la modulación de dianas terapéuticas ya identificadas por el CNIO.
 Por su parte, PharmaMar proporcionará al CNIO tanto el acceso, como los datos y material científico, de los compuestos puros y de la biblioteca de organismos marinos para trabajar conjuntamente en la detección de nuevas dianas terapéuticas frente a diferentes tipos de tumores.
Por su parte, PharmaMar proporcionará al CNIO tanto el acceso, como los datos y material científico, de los compuestos puros y de la biblioteca de organismos marinos para trabajar conjuntamente en la detección de nuevas dianas terapéuticas frente a diferentes tipos de tumores.
Blasco ha comentado que “este acuerdo con PharmaMar, compañía de referencia en el sector, pone de manifiesto la apuesta del CNIO por la colaboración con la industria para transferir los resultados de investigación a productos y servicios que beneficien a los pacientes y por tanto el Sistema Nacional de Salud”.
Sousa-Faro ha añadido: “España se sitúa entre los diez primeros países del mundo en la lucha contra el cáncer. Para nosotros invertir en I+D es clave para poder avanzar en el conocimiento de la ciencia. Firmar un acuerdo de colaboración con el CNIO, centro puntero y de referencia internacional en la investigación contra el cáncer, significa un paso más para poder seguir a la vanguardia y poder dar respuesta a necesidades médicas no cubiertas que necesitan una solución”.
PharmaMar, a las puertas de activar otra clara señal de fortaleza .
JM. Rodriguez // 21 Marzo 2017 // Bolsamania .
Por encima de la resistencia de los 3,2 euros presentaría el camino despejado hasta los máximos de 2015, en los 4,41 euros.
Tras las alzas de las últimas sesiones tenemos a los títulos de PharmaMar a las puertas de la resistencia, antes soporte, de los 3,20 euros.
Este nivel funcionó como soporte en agosto de 2015 y como resistencia en abril de 2016. Recientemente el título marcó un máximo en los 3,155 euros y desde ahí se giró de nuevo a la baja.
De lo que se puede deducir con facilidad que por encima de los 3,2 euros, con holgura y en velas semanales, tendríamos una clara y contundente señal de fortaleza que puede ser la antesala, con sus lógicas correcciones intermedias, de un movimiento en busca de los máximos de 2015 en los 4,40 euros.
Por encima de la resistencia de los 3,2 euros presentaría el camino despejado hasta los máximos de 2015, en los 4,41 euros.
Tras las alzas de las últimas sesiones tenemos a los títulos de PharmaMar a las puertas de la resistencia, antes soporte, de los 3,20 euros.
Este nivel funcionó como soporte en agosto de 2015 y como resistencia en abril de 2016. Recientemente el título marcó un máximo en los 3,155 euros y desde ahí se giró de nuevo a la baja.
De lo que se puede deducir con facilidad que por encima de los 3,2 euros, con holgura y en velas semanales, tendríamos una clara y contundente señal de fortaleza que puede ser la antesala, con sus lógicas correcciones intermedias, de un movimiento en busca de los máximos de 2015 en los 4,40 euros.
Luis Mora (PharmaMar): "La Compañía hoy está muy Infravalorada... por Comparables y por Fundamentales" /// "La Estrategia de la Compañía pasa por crear una red de ventas en Estados Unidos" .
Nieves Amigo Bolsamania | 21 mar, 2017 .
 *.- El Director General de PharmaMar afirma que están cumpliendo con sus planes y que esperan que 2017 sea un buen año .
*.- El Director General de PharmaMar afirma que están cumpliendo con sus planes y que esperan que 2017 sea un buen año .
*.- "PM1183 es la palanca que nos va a permitir crear esa infraestructura en Estados Unidos y recoger un importante EBITDA" .
*.- Esperamos Poder Pagar Dividendo en un Futuro no muy Lejano .
*.- La aprobación de Aplidina o el resultado del ensayo de cáncer de ovario para PM1183 son dos de los hitos más importantes para este año .
*.- "Estamos cumpliendo los plazos en cuanto a ensayos, que esperamos que sean positivos para poder presentar los dosieres. Los plazos van en perfecta armonía con la estrategia" .
*.- Mora confía en que los acontecimientos de 2017 hagan que el valor cumpla con los pronósticos de los analistas, que les dan un potencial de subida de más del 80% .
2017 podría ser el año en el que PharmaMar por fin despegara tras el letargo que vivió en bolsa en 2016 y después de las fuertes caídas que experimentó a finales de 2015. Hay acontecimientos importantes -que deberían llegar durante la segunda parte del año y que tienen que ver con dos de sus principales productos, Aplidina y PM1183- que prometen animar a la acción. El riesgo: no cumplir con el calendario y decepcionar al mercado.
De momento, "vamos en plazo", avisa Luis Mora, director general de esta biotecnológica que, como dato curioso, cuenta con tres ex ministros en su Consejo de Administración.
 Pregunta (P.): 2,3 millones, eso es lo que dicen los analistas que ganará PharmaMar en 2017. ¿Saldrán de pérdidas este año?
Pregunta (P.): 2,3 millones, eso es lo que dicen los analistas que ganará PharmaMar en 2017. ¿Saldrán de pérdidas este año?
Respuesta (R.): 2017 va a ser un año muy importante. A finales de año tendremos la opinión de la EMA (Agencia Europea de Medicamentos) para la aprobación de Aplidina, tendremos también los resultados del ensayo pivotal de cáncer de ovario para PM1183 y, si es positivo, empezaremos a preparar el dosier tanto para la FDA (Food and Drug Administration) como para la EMA. Con los acuerdos que ya hemos hecho, como el de Chugai para Japón, con la evolución positiva que prevemos para las ventas, esperamos que sea un buen año. Por otro lado, la inversión en Investigación y Desarrollo (I+D) absorberá bastantes recursos, pero esperamos que sea un buen año, aunque nunca damos guidance (previsiones) de resultados.
P.: En bolsa, los expertos les dan el mayor potencial de subida de todas las compañías del mercado español, de más del 80%. ¿Esperan que, con todos estos acontecimientos que ha mencionado para este año, el valor registre, al menos, parte de esa subida estimada?
R.: Al final el mercado tiene que reflejar los buenos resultados que estamos obteniendo. La compañía hoy está muy infravalorada... por comparables y por fundamentales. Ese potencial de subida se tiene que dar con todos los proyectos y todos los ensayos que están en marcha. Y más con la estrategia de la compañía, que es crear una red de ventas en Estados Unidos, que es el 46% del mercado mundial en oncología. Hemos sido capaces de hacerlo en Europa y pensamos que estamos capacitados para hacerlo en Estados Unidos. PM1183 es la palanca que nos va a permitir crear esa infraestructura en Estados Unidos y recoger un importante EBITDA.
P.: De todos los hitos que ha enumerado para este año 2017, ¿cuál diría que es clave y que sería una gran decepción si no llegase a cumplirse?
R.: No hay uno que resaltar. La aprobación de Aplidina por parte de la EMA -es nuestro segundo producto tras el Yondelis- es importante. El ensayo positivo de ovario para PM1183 es importante. Posibles licencias que pueden venir a lo largo del año... Yo no nombraría uno, sino los tres.
 P.: Sigamos hablando de su evolución en bolsa. El último gran batacazo de PharmaMar tuvo lugar entre octubre de 2015 y principios de 2016 y ustedes pidieron a la CNMV que investigara si había habido manipulación. Les dijeron que no y recurrieron. ¿Qué les contestó finalmente la CNMV?
P.: Sigamos hablando de su evolución en bolsa. El último gran batacazo de PharmaMar tuvo lugar entre octubre de 2015 y principios de 2016 y ustedes pidieron a la CNMV que investigara si había habido manipulación. Les dijeron que no y recurrieron. ¿Qué les contestó finalmente la CNMV?
R.: Todavía nada. Fue muy sorprendente porque, además, con la aprobación de Yondelis en el año 2015 en Estados Unidos, la acción perforó los 4 euros. Estaba todavía lejos de lo que nosotros entendemos que es su valoración, pero estábamos muy contentos porque por fin parecía que se estaba empezando a reflejar en el valor. A raíz de ahí, en una actuación incomprensible, empezó a haber unas caídas brutales de la acción y detectamos unos movimientos no claros. Además, observamos una forma de atacar al valor inusual, más si cabe cuando había habido una noticia buenísima y esperada desde hacia muchos años. Lo pusimos en manos de las autoridades y la primera contestación fue que no. Hemos recurrido y ahí estamos.
P.: En Estados Unidos, usted ha dicho que hay incertidumbre y que no es momento de salir a bolsa. Además, la última subida de tipos de la Fed no es la mejor noticia para el sector de biotecnología. ¿Descartan este proyecto para 2017?
R.: Estamos trabajando en ello pero todavía no tenemos fecha. No sé si será a finales de este año o si será el año que viene, pero ni mucho menos se ha descartado. Creo que el mercado americano es un mercado donde compañías como la nuestra tienen que estar por muchos motivos, por visibilidad, por especialización de analistas, bancos de inversión... Cuando haya una ventana importante que cree valor para el accionista, allí iremos.
P.: El tema de una OPA sobre la compañía es recurrente, y más a los precios a los que cotizan. ¿Ese interés que dice el presidente de PharmaMar que han demostrado “algunos”, proviene de España o del extranjero?
R.: Esto es algo que nosotros nunca comentamos. Una compañía como la nuestra, cotizando en España con la capitalización de mercado que tenemos, infravalorada... Es una compañía muy barata. Entiendo que hoy en día es una compañía apetecible para algunas compañías del sector. El riesgo esta ahí.
 P.: La estrategia de PharmaMar, que repiten como un mantra, es tener tres productos -Yondelis, Aplidin y PM1183- en cuatro años para cinco indicadores. ¿Van en plazo o temen decepcionar al mercado?
P.: La estrategia de PharmaMar, que repiten como un mantra, es tener tres productos -Yondelis, Aplidin y PM1183- en cuatro años para cinco indicadores. ¿Van en plazo o temen decepcionar al mercado?
R.: Vamos en plazo. Estamos cumpliendo los plazos en cuanto a ensayos, que esperamos que sean positivos para poder presentar los dosieres. Los plazos van en perfecta armonía con la estrategia.
P.: La mayoría de los analistas aconsejan comprar PharmaMar pero también están los que no confían en ustedes y tienen opiniones tan tajantes como las que dicen que ofrecen "poca claridad o transparencia en los datos clínicos". ¿Por qué creen que hay tanta polaridad en las opiniones hacia ustedes?
R.: Yo creo que sobre todo esto ocurre en España y es algo sorprendente. El año pasado hicimos más de 280 one to one (encuentros cara a cara con inversores) por EEUU y por toda Europa y la verdad es que no existe esa dicotomía, esa diferencia. En cuanto a la transparencia, es total, los datos son públicos. Las fases III son más largas, duran más, pero cuando se tienen los datos, se publican. Otra cosa es que se entienda o que en España muchos inversores quieran saber más a corto plazo, pero es que este negocio es así, los ensayos clínicos duran lo que duran.
P.: Ese interés de los inversores españoles por saber más a corto plazo también se nota en su evolución en bolsa. Da la impresión de que ustedes se mueven a golpe de noticia, sin que se valore el largo plazo.
R.: Claro, esa es la diferencia con un inversor americano. De las 170 compañías que están cotizando en el Nasdaq Biotech Index, tan solo un 10% tiene un EBITDA positivo, el resto tiene EBITDA negativo durante años, pero la creación de valor se percibe en cuanto que van pasando de fase y van publicando los datos en los congresos. Entender ese valor de los productos en las aplicaciones clínicas no siempre es sencillo. Pero, afortunadamente, es cierto que se está aumentando este nivel de conocimiento también en España entre muchos inversores. También es cierto que este 'cortoplacismo' que existe aquí se debe mucho a la tradición inversora que hay en España, que plantea que los resultados deben dejar un dividendo. En la cultura nuestra, ese dividendo es importante...
P.: Y ustedes el dividendo lo tienen por ahora descartado...
R.: Hemos dado EBITDA negativo, no podemos dar dividendo, pero sí esperamos que, con toda esta evolución de la cartera, en un futuro no muy lejano, se pueda pagar dividendo, obviamente.
 *.- El Director General de PharmaMar afirma que están cumpliendo con sus planes y que esperan que 2017 sea un buen año .
*.- El Director General de PharmaMar afirma que están cumpliendo con sus planes y que esperan que 2017 sea un buen año .*.- "PM1183 es la palanca que nos va a permitir crear esa infraestructura en Estados Unidos y recoger un importante EBITDA" .
*.- Esperamos Poder Pagar Dividendo en un Futuro no muy Lejano .
*.- La aprobación de Aplidina o el resultado del ensayo de cáncer de ovario para PM1183 son dos de los hitos más importantes para este año .
*.- "Estamos cumpliendo los plazos en cuanto a ensayos, que esperamos que sean positivos para poder presentar los dosieres. Los plazos van en perfecta armonía con la estrategia" .
*.- Mora confía en que los acontecimientos de 2017 hagan que el valor cumpla con los pronósticos de los analistas, que les dan un potencial de subida de más del 80% .
2017 podría ser el año en el que PharmaMar por fin despegara tras el letargo que vivió en bolsa en 2016 y después de las fuertes caídas que experimentó a finales de 2015. Hay acontecimientos importantes -que deberían llegar durante la segunda parte del año y que tienen que ver con dos de sus principales productos, Aplidina y PM1183- que prometen animar a la acción. El riesgo: no cumplir con el calendario y decepcionar al mercado.
De momento, "vamos en plazo", avisa Luis Mora, director general de esta biotecnológica que, como dato curioso, cuenta con tres ex ministros en su Consejo de Administración.
Respuesta (R.): 2017 va a ser un año muy importante. A finales de año tendremos la opinión de la EMA (Agencia Europea de Medicamentos) para la aprobación de Aplidina, tendremos también los resultados del ensayo pivotal de cáncer de ovario para PM1183 y, si es positivo, empezaremos a preparar el dosier tanto para la FDA (Food and Drug Administration) como para la EMA. Con los acuerdos que ya hemos hecho, como el de Chugai para Japón, con la evolución positiva que prevemos para las ventas, esperamos que sea un buen año. Por otro lado, la inversión en Investigación y Desarrollo (I+D) absorberá bastantes recursos, pero esperamos que sea un buen año, aunque nunca damos guidance (previsiones) de resultados.
P.: En bolsa, los expertos les dan el mayor potencial de subida de todas las compañías del mercado español, de más del 80%. ¿Esperan que, con todos estos acontecimientos que ha mencionado para este año, el valor registre, al menos, parte de esa subida estimada?
R.: Al final el mercado tiene que reflejar los buenos resultados que estamos obteniendo. La compañía hoy está muy infravalorada... por comparables y por fundamentales. Ese potencial de subida se tiene que dar con todos los proyectos y todos los ensayos que están en marcha. Y más con la estrategia de la compañía, que es crear una red de ventas en Estados Unidos, que es el 46% del mercado mundial en oncología. Hemos sido capaces de hacerlo en Europa y pensamos que estamos capacitados para hacerlo en Estados Unidos. PM1183 es la palanca que nos va a permitir crear esa infraestructura en Estados Unidos y recoger un importante EBITDA.
P.: De todos los hitos que ha enumerado para este año 2017, ¿cuál diría que es clave y que sería una gran decepción si no llegase a cumplirse?
R.: No hay uno que resaltar. La aprobación de Aplidina por parte de la EMA -es nuestro segundo producto tras el Yondelis- es importante. El ensayo positivo de ovario para PM1183 es importante. Posibles licencias que pueden venir a lo largo del año... Yo no nombraría uno, sino los tres.
 P.: Sigamos hablando de su evolución en bolsa. El último gran batacazo de PharmaMar tuvo lugar entre octubre de 2015 y principios de 2016 y ustedes pidieron a la CNMV que investigara si había habido manipulación. Les dijeron que no y recurrieron. ¿Qué les contestó finalmente la CNMV?
P.: Sigamos hablando de su evolución en bolsa. El último gran batacazo de PharmaMar tuvo lugar entre octubre de 2015 y principios de 2016 y ustedes pidieron a la CNMV que investigara si había habido manipulación. Les dijeron que no y recurrieron. ¿Qué les contestó finalmente la CNMV?R.: Todavía nada. Fue muy sorprendente porque, además, con la aprobación de Yondelis en el año 2015 en Estados Unidos, la acción perforó los 4 euros. Estaba todavía lejos de lo que nosotros entendemos que es su valoración, pero estábamos muy contentos porque por fin parecía que se estaba empezando a reflejar en el valor. A raíz de ahí, en una actuación incomprensible, empezó a haber unas caídas brutales de la acción y detectamos unos movimientos no claros. Además, observamos una forma de atacar al valor inusual, más si cabe cuando había habido una noticia buenísima y esperada desde hacia muchos años. Lo pusimos en manos de las autoridades y la primera contestación fue que no. Hemos recurrido y ahí estamos.
P.: En Estados Unidos, usted ha dicho que hay incertidumbre y que no es momento de salir a bolsa. Además, la última subida de tipos de la Fed no es la mejor noticia para el sector de biotecnología. ¿Descartan este proyecto para 2017?
R.: Estamos trabajando en ello pero todavía no tenemos fecha. No sé si será a finales de este año o si será el año que viene, pero ni mucho menos se ha descartado. Creo que el mercado americano es un mercado donde compañías como la nuestra tienen que estar por muchos motivos, por visibilidad, por especialización de analistas, bancos de inversión... Cuando haya una ventana importante que cree valor para el accionista, allí iremos.
P.: El tema de una OPA sobre la compañía es recurrente, y más a los precios a los que cotizan. ¿Ese interés que dice el presidente de PharmaMar que han demostrado “algunos”, proviene de España o del extranjero?
R.: Esto es algo que nosotros nunca comentamos. Una compañía como la nuestra, cotizando en España con la capitalización de mercado que tenemos, infravalorada... Es una compañía muy barata. Entiendo que hoy en día es una compañía apetecible para algunas compañías del sector. El riesgo esta ahí.
 P.: La estrategia de PharmaMar, que repiten como un mantra, es tener tres productos -Yondelis, Aplidin y PM1183- en cuatro años para cinco indicadores. ¿Van en plazo o temen decepcionar al mercado?
P.: La estrategia de PharmaMar, que repiten como un mantra, es tener tres productos -Yondelis, Aplidin y PM1183- en cuatro años para cinco indicadores. ¿Van en plazo o temen decepcionar al mercado?R.: Vamos en plazo. Estamos cumpliendo los plazos en cuanto a ensayos, que esperamos que sean positivos para poder presentar los dosieres. Los plazos van en perfecta armonía con la estrategia.
P.: La mayoría de los analistas aconsejan comprar PharmaMar pero también están los que no confían en ustedes y tienen opiniones tan tajantes como las que dicen que ofrecen "poca claridad o transparencia en los datos clínicos". ¿Por qué creen que hay tanta polaridad en las opiniones hacia ustedes?
R.: Yo creo que sobre todo esto ocurre en España y es algo sorprendente. El año pasado hicimos más de 280 one to one (encuentros cara a cara con inversores) por EEUU y por toda Europa y la verdad es que no existe esa dicotomía, esa diferencia. En cuanto a la transparencia, es total, los datos son públicos. Las fases III son más largas, duran más, pero cuando se tienen los datos, se publican. Otra cosa es que se entienda o que en España muchos inversores quieran saber más a corto plazo, pero es que este negocio es así, los ensayos clínicos duran lo que duran.
P.: Ese interés de los inversores españoles por saber más a corto plazo también se nota en su evolución en bolsa. Da la impresión de que ustedes se mueven a golpe de noticia, sin que se valore el largo plazo.
R.: Claro, esa es la diferencia con un inversor americano. De las 170 compañías que están cotizando en el Nasdaq Biotech Index, tan solo un 10% tiene un EBITDA positivo, el resto tiene EBITDA negativo durante años, pero la creación de valor se percibe en cuanto que van pasando de fase y van publicando los datos en los congresos. Entender ese valor de los productos en las aplicaciones clínicas no siempre es sencillo. Pero, afortunadamente, es cierto que se está aumentando este nivel de conocimiento también en España entre muchos inversores. También es cierto que este 'cortoplacismo' que existe aquí se debe mucho a la tradición inversora que hay en España, que plantea que los resultados deben dejar un dividendo. En la cultura nuestra, ese dividendo es importante...
P.: Y ustedes el dividendo lo tienen por ahora descartado...
R.: Hemos dado EBITDA negativo, no podemos dar dividendo, pero sí esperamos que, con toda esta evolución de la cartera, en un futuro no muy lejano, se pueda pagar dividendo, obviamente.
Pharma Mar Vuelve a Tratar de Romper Resistencia .
Publicado el 20 de Marzo de 2017 por Invertir y Especular .
La acción lleva tirando fuerte tres sesiones con volumen tras doble suelo en zona cercana a 2.6, pero entre 3 y 3.2 tiene una fuerte resistencia, en nuestro último comentario decíamos que si la rompía hasta 4 euros no había nada a su paso.
Noten como cada vez arranca desde más arriba pero muere en el mismo sitio sus impulsos, en realidad quien compró el abril del año pasado simplemente está a precio.
A ver si de una vez por todas se deshace de este nivel de control, no nos parece casualidad desde luego que de 3-3.20 no se pase.

La acción lleva tirando fuerte tres sesiones con volumen tras doble suelo en zona cercana a 2.6, pero entre 3 y 3.2 tiene una fuerte resistencia, en nuestro último comentario decíamos que si la rompía hasta 4 euros no había nada a su paso.
Noten como cada vez arranca desde más arriba pero muere en el mismo sitio sus impulsos, en realidad quien compró el abril del año pasado simplemente está a precio.
A ver si de una vez por todas se deshace de este nivel de control, no nos parece casualidad desde luego que de 3-3.20 no se pase.

Suscribirse a:
Comentarios (Atom)















