LURBINECTEDIN SE APROBÓ EN ESTADOS UNIDOS ... Y PHARMAMAR BAJÓ EL MISMO DÍA /// SE APROBÓ EN SUIZA ... Y PHARMAMAR BAJO EL MISMO DÍA /// SE APROBÓ EN CHINA ... Y PHARMAMAR BAJÓ EL MISMO DÍA ...
31 mayo 2017
PharmaMar Presentara en el Congreso de ASCO ( 2 al 6 de Junio en Chicago ) Resultados del PM1183 ( Lurbinectedin ) en Endometrio y Mama . La Fase III para la Indicación de Endometrio con PM1183 ya esta Diseñandose con el Beneplacito de la FDA .
PharmaMar Presentará Nuevos Datos con sus Compuestos Yondelis® y Lurbinectedin Durante ASCO 2017 .

*.- Tras los Resultados Positivos Obtenidos en Cáncer de Endometrio con Lurbinectedina, PharmaMar tiene la Intención de Iniciar un Estudio de Registro de Fase III .
*.- Además, cuenta ya con la conformidad al diseño del estudio por parte de la FDA .
Madrid, 18 de mayo de 2017.
PharmaMar (MSE:PHM) presentará los datos obtenidos en varios estudios clínicos con los inhibidores de la transcripción activada, Yondelis® y lurbinectedina, durante el 53º congreso de la Sociedad Americana de Oncología Clínica (ASCO, por sus siglas en inglés), que se celebrará del 2 al 6 de junio en Chicago (Estados Unidos).
Durante el congreso, PharmaMar participará con varias presentaciones sobre Yondelis® en mesotelioma pleural maligno junto con un estudio prospectivo sobre la combinación con radioterapia en sarcoma de tejidos blandos.
Por otro lado, la Compañía continúa con el desarrollo clínico de lurbinectedina (PM1183) para el tratamiento de enfermedades como Cáncer de Endometrio y Cáncer de Mama Metastásico con Mutación en el Gen BRCA 2, cuyos resultados se harán públicos en este Congreso.

*.- Tras los Resultados Positivos Obtenidos en Cáncer de Endometrio con Lurbinectedina, PharmaMar tiene la Intención de Iniciar un Estudio de Registro de Fase III .
*.- Además, cuenta ya con la conformidad al diseño del estudio por parte de la FDA .
Madrid, 18 de mayo de 2017.
PharmaMar (MSE:PHM) presentará los datos obtenidos en varios estudios clínicos con los inhibidores de la transcripción activada, Yondelis® y lurbinectedina, durante el 53º congreso de la Sociedad Americana de Oncología Clínica (ASCO, por sus siglas en inglés), que se celebrará del 2 al 6 de junio en Chicago (Estados Unidos).
Durante el congreso, PharmaMar participará con varias presentaciones sobre Yondelis® en mesotelioma pleural maligno junto con un estudio prospectivo sobre la combinación con radioterapia en sarcoma de tejidos blandos.
Por otro lado, la Compañía continúa con el desarrollo clínico de lurbinectedina (PM1183) para el tratamiento de enfermedades como Cáncer de Endometrio y Cáncer de Mama Metastásico con Mutación en el Gen BRCA 2, cuyos resultados se harán públicos en este Congreso.
SYL1001 . Sylentis Calcula que Podría Alcanzar Hasta un 15 ó un 17 % de un Mercado Potencial de unos 2.300 Millones $ .
Sylentis ... Filial 100 % de Pharmamar Espera Acabar Ensayo Para Ojo Seco En Primavera de 2018 .
Reuters - Madrid // 30 de mayo de 2017.
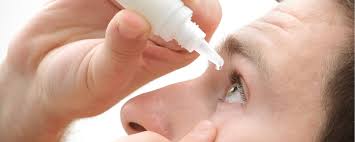
Sylentis, filial del grupo Pharmamar, calcula que el ensayo en fase III que acaba de iniciar para el síndrome del ojo seco podría estar concluido en la primavera de 2018, dijeron el martes responsables de la farmacéutica.
La filial especializada en dolencias oftalmológicas e inflamatorias de Pharmamar anunció la víspera que acababa de empezar a reclutar a unos 300 pacientes en cinco países europeos para el ensayo en fase III para ojo seco, una dolencia que afecta a más de 300 millones de personas en todo el mundo, sobre todo a mujeres.
Los cinco principales países europeos más Estados Unidos, Japón e India aglutinan un mercado potencial de 2.300 millones de dólares para esta enfermedad, que se prevé que se duplique en la próxima década, dijo Ana Isabel Jiménez, directora de I+D de Sylentis en un encuentro con periodistas celebrado en Madrid.
Sylentis calcula que con este fármaco podría alcanzar hasta un 15 ó un 17 por ciento del mercado.
El síndrome del ojo seco se produce cuando el ojo no produce lágrimas de manera correcta o cuando éstas no tienen la consistencia necesaria o se evaporan muy rápido, provocando dolor, picor, quemazón e irritación.
Reuters - Madrid // 30 de mayo de 2017.
Sylentis, filial del grupo Pharmamar, calcula que el ensayo en fase III que acaba de iniciar para el síndrome del ojo seco podría estar concluido en la primavera de 2018, dijeron el martes responsables de la farmacéutica.
La filial especializada en dolencias oftalmológicas e inflamatorias de Pharmamar anunció la víspera que acababa de empezar a reclutar a unos 300 pacientes en cinco países europeos para el ensayo en fase III para ojo seco, una dolencia que afecta a más de 300 millones de personas en todo el mundo, sobre todo a mujeres.
Los cinco principales países europeos más Estados Unidos, Japón e India aglutinan un mercado potencial de 2.300 millones de dólares para esta enfermedad, que se prevé que se duplique en la próxima década, dijo Ana Isabel Jiménez, directora de I+D de Sylentis en un encuentro con periodistas celebrado en Madrid.
Sylentis calcula que con este fármaco podría alcanzar hasta un 15 ó un 17 por ciento del mercado.
El síndrome del ojo seco se produce cuando el ojo no produce lágrimas de manera correcta o cuando éstas no tienen la consistencia necesaria o se evaporan muy rápido, provocando dolor, picor, quemazón e irritación.
30 mayo 2017
SYL1001 ya en Fase III . El Diseño del Estudio ha sido Acordado con la Agencia Americana del Medicamento ( FDA ) .
Sylentis inicia un estudio de fase III para el tratamiento del ojo seco .
MADRID, 30 May. (EUROPA PRESS) .
 Sylentis (participada por PharmaMar al 100%) ha anunciado el inicio del primer estudio de fase III, denominado 'HELIX', con su medicamento en investigación SYL1001 para la indicación del síndrome de ojo seco.
Sylentis (participada por PharmaMar al 100%) ha anunciado el inicio del primer estudio de fase III, denominado 'HELIX', con su medicamento en investigación SYL1001 para la indicación del síndrome de ojo seco.
El diseño del estudio ha sido acordado con la Agencia Americana del Medicamento (FDA, por sus siglas en inglés) y formará parte de la solicitud de autorización de comercialización.
SYL1001 supone un avance en el desarrollo de fármacos innovadores en diferentes áreas terapéuticas a través de una tecnología novedosa de silenciamiento génico basada en el RNA de interferencia (RNAi).
Concretamente, en el estudio participarán más de 30 hospitales de 5 países europeos, entre los que se encuentra España, con el objetivo de evaluar el efecto de la solución oftálmica SYL1001 en los signos y síntomas de 300 pacientes con esta patología para la que apenas hay opciones terapéuticas. Y es que, SYL1001 es un fármaco basado en RNAi administrado en forma de gotas oftálmicas que bloquea la síntesis de un receptor implicado en la patología del síndrome de ojo seco.
"El RNA de interferencia en el que trabajamos podría mejorar a los pacientes que sufren esta patología ya que este producto podría reducir los parámetros inflamatorios de la superficie ocular, podría mejorar la calidad de la lágrima y podría reducir el dolor ocular asociado al síndrome de ojo seco. Consideramos que nuestro fármaco SYL1001 podría ser una alternativa terapéutica muy eficaz e importante para estos pacientes", ha comentado la directora de I+D de Sylentis, Ana Isabel Jiménez.
La compañía trabaja en la investigación de nuevos tratamientos para enfermedades oftalmológicas e inflamatorias. Así, según ha señalado la experta, actualmente la línea de trabajo en la que ha avanzado "más rápido" es la de oftalmología para el tratamiento de enfermedades como el síndrome de ojo seco, alergias oculares y enfermedades de la retina.
El RNA de interferencia es una tecnología innovadora que busca reducir la producción anómala de proteínas silenciando el RNA mensajero. El RNAi representa un avance por ser un nuevo mecanismo de acción para hacer frente a numerosas patologías. Actualmente hay dos productos basados en la tecnología del silenciamiento génico en el mercado para otras y numerosos productos en diferentes etapas de desarrollo clínico para diferentes indicaciones.
"Esta tecnología es muy prometedora como tratamiento para enfermedades oculares porque permite el abordaje de la enfermedad desde un nuevo mecanismo de acción y frente a dianas terapéuticas nuevas. Además, en todos los estudios clínicos en los que hemos participado se ha demostrado la eficacia del SYL1001 en los pacientes además de una alta tolerancia y seguridad por la superficie ocular", ha explicado el catedrático de oftalmología y jefe de sección de la Unidad de Superficie e Inflamación ocular del Hospital Clínico San Carlos en Madrid, José Manuel Benítez del Castillo Sánchez.
Los compuestos basados en la tecnología del RNAi suelen tener un efecto más prolongado que los fármacos tradicionales. "Esta propiedad es particularmente interesante en las enfermedades crónicas y en enfermedades en las que el cumplimiento de la pauta de tratamiento es un reto, ya que se incrementa la duración del efecto y la eficacia a largo plazo", ha zanjado Benítez Del Castillo.
MADRID, 30 May. (EUROPA PRESS) .
 Sylentis (participada por PharmaMar al 100%) ha anunciado el inicio del primer estudio de fase III, denominado 'HELIX', con su medicamento en investigación SYL1001 para la indicación del síndrome de ojo seco.
Sylentis (participada por PharmaMar al 100%) ha anunciado el inicio del primer estudio de fase III, denominado 'HELIX', con su medicamento en investigación SYL1001 para la indicación del síndrome de ojo seco. El diseño del estudio ha sido acordado con la Agencia Americana del Medicamento (FDA, por sus siglas en inglés) y formará parte de la solicitud de autorización de comercialización.
SYL1001 supone un avance en el desarrollo de fármacos innovadores en diferentes áreas terapéuticas a través de una tecnología novedosa de silenciamiento génico basada en el RNA de interferencia (RNAi).
Concretamente, en el estudio participarán más de 30 hospitales de 5 países europeos, entre los que se encuentra España, con el objetivo de evaluar el efecto de la solución oftálmica SYL1001 en los signos y síntomas de 300 pacientes con esta patología para la que apenas hay opciones terapéuticas. Y es que, SYL1001 es un fármaco basado en RNAi administrado en forma de gotas oftálmicas que bloquea la síntesis de un receptor implicado en la patología del síndrome de ojo seco.
"El RNA de interferencia en el que trabajamos podría mejorar a los pacientes que sufren esta patología ya que este producto podría reducir los parámetros inflamatorios de la superficie ocular, podría mejorar la calidad de la lágrima y podría reducir el dolor ocular asociado al síndrome de ojo seco. Consideramos que nuestro fármaco SYL1001 podría ser una alternativa terapéutica muy eficaz e importante para estos pacientes", ha comentado la directora de I+D de Sylentis, Ana Isabel Jiménez.
La compañía trabaja en la investigación de nuevos tratamientos para enfermedades oftalmológicas e inflamatorias. Así, según ha señalado la experta, actualmente la línea de trabajo en la que ha avanzado "más rápido" es la de oftalmología para el tratamiento de enfermedades como el síndrome de ojo seco, alergias oculares y enfermedades de la retina.
El RNA de interferencia es una tecnología innovadora que busca reducir la producción anómala de proteínas silenciando el RNA mensajero. El RNAi representa un avance por ser un nuevo mecanismo de acción para hacer frente a numerosas patologías. Actualmente hay dos productos basados en la tecnología del silenciamiento génico en el mercado para otras y numerosos productos en diferentes etapas de desarrollo clínico para diferentes indicaciones.
"Esta tecnología es muy prometedora como tratamiento para enfermedades oculares porque permite el abordaje de la enfermedad desde un nuevo mecanismo de acción y frente a dianas terapéuticas nuevas. Además, en todos los estudios clínicos en los que hemos participado se ha demostrado la eficacia del SYL1001 en los pacientes además de una alta tolerancia y seguridad por la superficie ocular", ha explicado el catedrático de oftalmología y jefe de sección de la Unidad de Superficie e Inflamación ocular del Hospital Clínico San Carlos en Madrid, José Manuel Benítez del Castillo Sánchez.
Los compuestos basados en la tecnología del RNAi suelen tener un efecto más prolongado que los fármacos tradicionales. "Esta propiedad es particularmente interesante en las enfermedades crónicas y en enfermedades en las que el cumplimiento de la pauta de tratamiento es un reto, ya que se incrementa la duración del efecto y la eficacia a largo plazo", ha zanjado Benítez Del Castillo.
29 mayo 2017
SYL1001 de Sylentis ( Grupo PharmaMar ) Inicia la Fase III . Un Ensayo del que se Podría Resultados a Finales del 2018 .
PharmaMar . Uno de los Valores más Alcistas del Mercado Continuo en este Momento .
PharmaMar una de las que compañías más alcistas en este momento, como indica nuestro Especial Biotecnología donde el equipo de análisis de Estrategias de Inversión realizo un informe con análisis técnico y fundamental de las 11 compañías cotizadas del sector ya valoraba positivamente a Pharmamar, ya que la empresa se está expandiendo a nivel comercial, tiene buen 'pipeline' (Aplidin y Lurbinectedin) y el desarrollo operativo de la empresa y sus fundamentales bursátiles son muy positivos.

Las ventas del 4T-16 sorprendieron al mercado positivamente (creciendo al 21%) mejorando significativamente el crecimiento del Yondelis aunque a nivel de márgenes se ven afectados por la inversión de la compañía con sus 'cash flows' operativos.
En 2016 facturaron 169,7 millones de euros y tuvieron pérdidas a nivel de márgenes por las inversiones en i+D realizadas.
No obstante, prevemos fuertes crecimientos a medio plazo para Pharma Mar derivado del Yondelis y el lanzamiento de nuevos productos (Aplidin y PM1183) con lo que para 2017 estimamos ventas de 183,7 millones de euros (que equivaldría a un incremento interanual del 8,2%), pérdidas aún a nivel de margen neto pero ya 'cash flow' libre positivo (FCF yield del 2,5%).
En 2016 facturaron 169,7 millones de euros y tuvieron pérdidas a nivel de márgenes por las inversiones en i+D realizadas.
No obstante, prevemos fuertes crecimientos a medio plazo para Pharma Mar derivado del Yondelis y el lanzamiento de nuevos productos (Aplidin y PM1183) con lo que para 2017 estimamos ventas de 183,7 millones de euros (que equivaldría a un incremento interanual del 8,2%), pérdidas aún a nivel de margen neto pero ya 'cash flow' libre positivo (FCF yield del 2,5%).
A medio plazo con el pipeline Pharma Mar podría crecer a tasas superiores al 20% y prevemos creación de valor para el accionista con RoE´s a medio plazo superiores al 20%, el coste del 'equity' según nuestro modelo es del 8,2% y con crecimientos sostenibles a medio plazo de doble dígito.
Creemos puede ser atractiva la inversión en el valor y su fuerte tendencia podría continuar.
Creemos puede ser atractiva la inversión en el valor y su fuerte tendencia podría continuar.
Radón : El Riesgo de Cáncer que Emana del Suelo -
 *.- Se trata de un gas incoloro e inodoro producto de la desintegración del uranio y del torio, presente en casi todos los suelos y rocas.
*.- Se trata de un gas incoloro e inodoro producto de la desintegración del uranio y del torio, presente en casi todos los suelos y rocas.*.- Los expertos reconocen que el conocimiento en general es muy bajo: "Es un potencial riesgo para la salud, deberías saber si estás en riesgo y hacer algo".
*.- La única forma de saberlo, explican, es "medirlo" con unos pequeños aparatos que se colocan en una habitación durante un número de meses.
EFE. 28.05.2017 .
El tabaco es la principal causa de cáncer de pulmón como es bien conocido y, la segunda, es el radón, un gas radiactivo de origen natural cuya presencia en las viviendas en grandes concentraciones eleva el riesgo de padecer un tumor. Aunque la Organización Mundial de la Salud (OMS) lleva casi cuatro décadas advirtiendo de los efectos del radón, los expertos reconocen que el nivel de conocimiento del público en general es muy bajo.
"Los científicos quizás comunicamos esto en términos científicos pero no en términos que la gente entiende. El mensaje claro debería ser: es un potencial riesgo para la salud y deberías saber si estás en riesgo y, si lo estás, hacer algo", explica en Viena Tony Colgan, jefe de la división de protección radiológica del OIEA. Este experto del Organismo Internacional de Energía Atómica (OIEA) señala que la gente se preocupa mucho más de la radiación que procede de operaciones nucleares industriales, pese a ser menor y suponer menos riesgo, que del radón, responsable del 40% de media de la dosis de radiación que recibe una persona.
...
27 mayo 2017
ASCO . Las Farmacéuticas Ultiman la Presentación de sus Avances en Oncología para ASCO 2017 .
Comienza la cuenta atrás para la cita mundial más relevante sobre investigación en el campo de la oncología, la 53 edición de la Reunión de la Asociación Americana de Oncología Clínica (ASCO). Las compañías farmacéuticas empiezan ya a dar las primeras pinceladas sobre las novedades que darán a conocer en esta cita global, que reúne todos los años en Chicago entre el 2 y el 6 de junio a más de 30.000 profesionales entre oncólogos, investigadores básicos e industria farmacéutica .

J. A. R. Barcelona | 26 may 2017 .
GacetaMedicaCom
El próximo congreso de la Sociedad Americana de Oncología Clínica (ASCO) arranca el próximo 2 de junio hasta el día 6 con la presencia de más de 35.000 expertos de todo el mundo para conocer los principales avances en el tratamiento, el diagnóstico y la epidemiología de las neoplasias.
Entre los temas principales del congreso, destacan las novedades en el campo del cáncer de colon, uno de los más frecuentes. En este sentido, se presentará un importante estudio que pone de manifiesto la relevancia del estilo de vida no solo para prevenir la aparición de los tumores de colon sino también para evitar recurrencias una vez diagnosticados. Así, un trabajo con 992 pacientes con cáncer de colon en estadio 3 demuestra que aquellos con un estilo de vida más saludable durante y después del tratamiento adyuvante presentaban un 42 por ciento menos de riesgo de sufrir una recurrencia. Los tres factores determinantes para definir el estilo de vida como saludable eran: mantener un peso adecuado, realizar actividad física con regularidad y llevar una dieta equilibrada y rica en fibra.
En el campo del cáncer de vías biliares, se esperan con expectación los resultados detallados de un estudio randomizado fase 3 con 447 pacientes que muestra que dar capecitabina después de la cirugía alarga la supervivencia una mediana de 15 meses en comparación con solo cirugía. De este modo, se debatirá si añadir este agente quimioterápico tras la cirugía podría convertirse en el nuevo estándar de tratamiento.
Por otro lado, la inmunooncología también tendrá un protagonismo destacado. Novedades que estarán relacionadas con los enfoques de respuesta a daño de ADN o inmunoterapias de carácter bifuncional, es decir, dirigidas simultáneamente a dos dianas del sistema inmune.
Otra de las novedades importantes tendrá que ver con el cáncer de pulmón. En este sentido, la quimioterapia es el tratamiento estándar para prevenir la recurrencia en este tipo de neoplasia. Pero un trabajo muestra que gefitinib (Iressa, de AstraZeneca) parece más eficaz para prevenir el riesgo de recurrencia, como se ha demostrado en un estudio fase 3 en pacientes con EGFR positivo que recibieron este fármaco durante 10 meses.
Asimismo, se presentarán trabajos que señalan la necesidad de aumentar las tasas de vacunación contra el VPH para combatir el cáncer asociado a este virus.

J. A. R. Barcelona | 26 may 2017 .
GacetaMedicaCom
El próximo congreso de la Sociedad Americana de Oncología Clínica (ASCO) arranca el próximo 2 de junio hasta el día 6 con la presencia de más de 35.000 expertos de todo el mundo para conocer los principales avances en el tratamiento, el diagnóstico y la epidemiología de las neoplasias.
Entre los temas principales del congreso, destacan las novedades en el campo del cáncer de colon, uno de los más frecuentes. En este sentido, se presentará un importante estudio que pone de manifiesto la relevancia del estilo de vida no solo para prevenir la aparición de los tumores de colon sino también para evitar recurrencias una vez diagnosticados. Así, un trabajo con 992 pacientes con cáncer de colon en estadio 3 demuestra que aquellos con un estilo de vida más saludable durante y después del tratamiento adyuvante presentaban un 42 por ciento menos de riesgo de sufrir una recurrencia. Los tres factores determinantes para definir el estilo de vida como saludable eran: mantener un peso adecuado, realizar actividad física con regularidad y llevar una dieta equilibrada y rica en fibra.
En el campo del cáncer de vías biliares, se esperan con expectación los resultados detallados de un estudio randomizado fase 3 con 447 pacientes que muestra que dar capecitabina después de la cirugía alarga la supervivencia una mediana de 15 meses en comparación con solo cirugía. De este modo, se debatirá si añadir este agente quimioterápico tras la cirugía podría convertirse en el nuevo estándar de tratamiento.
Por otro lado, la inmunooncología también tendrá un protagonismo destacado. Novedades que estarán relacionadas con los enfoques de respuesta a daño de ADN o inmunoterapias de carácter bifuncional, es decir, dirigidas simultáneamente a dos dianas del sistema inmune.
Otra de las novedades importantes tendrá que ver con el cáncer de pulmón. En este sentido, la quimioterapia es el tratamiento estándar para prevenir la recurrencia en este tipo de neoplasia. Pero un trabajo muestra que gefitinib (Iressa, de AstraZeneca) parece más eficaz para prevenir el riesgo de recurrencia, como se ha demostrado en un estudio fase 3 en pacientes con EGFR positivo que recibieron este fármaco durante 10 meses.
Asimismo, se presentarán trabajos que señalan la necesidad de aumentar las tasas de vacunación contra el VPH para combatir el cáncer asociado a este virus.
PharmaMar . 500.000 Acciones para ser entregadas a sus Empleados y Directivos cuyo Rendimiento durante este año sea Satisfactorio.
POR EP // 26/05/2017 .
El objetivo de la empresa es premiar a los empleados y directivos cuyo rendimiento durante este año sea satisfactorio.

El consejo de administración de Pharma Mar ha acordado proponer a sus accionistas un plan de entrega gratuita de acciones para el ejercicio 2018 a directivos y empleados del grupo mediante el que repartirá un máximo de 500.000 títulos, según ha informado a la Comisión Nacional del Mercado de Valores (CNMV).
Se trata de un plan al que podrán acogerse los directivos y trabajadores de la compañía que, con contrato indefinido y percibiendo una retribución variable, cumplan más del 50% de sus objetivos fijados para el ejercicio 2017.
La compañía ha señalado que los objetivos de la propuesta son premiar a los empleados y directivos cuyo rendimiento durante 2017 sea satisfactorio e incentivar a sus destinatarios para su permanencia en el grupo.
Por otro lado, pedirá a los accionistas autorización para la adquisición derivativa de acciones propias por un precio mínimo correspondiente a su valor nominal y un máximo del 10% del precio de negociación de las acciones de la sociedad en la sesión bursátil del momento de adquisición.
El próximo 29 de junio, la junta de accionistas de Pharma Mar también votará la aprobación de las cuentas anuales del pasado ejercicio y la decisión del consejo de destinar las pérdidas de 11,47 millones de euros a incrementar el saldo de la cuenta de resultados negativos de ejercicios anteriores.
Asimismo, el consejo de administración pedirá autorización para poder aumentar el capital de la sociedad, dentro del plazo máximo de cinco años y si lo estima conveniente, hasta por una cifra igual a la mitad actual del capital social, en una o varias veces, y en la oportunidad y cuantía que considere adecuadas, con la facultad de excluir el derecho de suscripción preferente que quedaría limitado al 20% del capital social de la compañía.
El orden del día de la junta también incluirá la aprobación de la gestión del consejo de administración de Pharma Mar durante el pasado ejercicio, su informe anual sobre remuneraciones de los conejeros y la reelección de la consultora PricewaterhouseCoopers para auditar las cuentas del grupo.
El objetivo de la empresa es premiar a los empleados y directivos cuyo rendimiento durante este año sea satisfactorio.

El consejo de administración de Pharma Mar ha acordado proponer a sus accionistas un plan de entrega gratuita de acciones para el ejercicio 2018 a directivos y empleados del grupo mediante el que repartirá un máximo de 500.000 títulos, según ha informado a la Comisión Nacional del Mercado de Valores (CNMV).
Se trata de un plan al que podrán acogerse los directivos y trabajadores de la compañía que, con contrato indefinido y percibiendo una retribución variable, cumplan más del 50% de sus objetivos fijados para el ejercicio 2017.
La compañía ha señalado que los objetivos de la propuesta son premiar a los empleados y directivos cuyo rendimiento durante 2017 sea satisfactorio e incentivar a sus destinatarios para su permanencia en el grupo.
Por otro lado, pedirá a los accionistas autorización para la adquisición derivativa de acciones propias por un precio mínimo correspondiente a su valor nominal y un máximo del 10% del precio de negociación de las acciones de la sociedad en la sesión bursátil del momento de adquisición.
El próximo 29 de junio, la junta de accionistas de Pharma Mar también votará la aprobación de las cuentas anuales del pasado ejercicio y la decisión del consejo de destinar las pérdidas de 11,47 millones de euros a incrementar el saldo de la cuenta de resultados negativos de ejercicios anteriores.
Asimismo, el consejo de administración pedirá autorización para poder aumentar el capital de la sociedad, dentro del plazo máximo de cinco años y si lo estima conveniente, hasta por una cifra igual a la mitad actual del capital social, en una o varias veces, y en la oportunidad y cuantía que considere adecuadas, con la facultad de excluir el derecho de suscripción preferente que quedaría limitado al 20% del capital social de la compañía.
El orden del día de la junta también incluirá la aprobación de la gestión del consejo de administración de Pharma Mar durante el pasado ejercicio, su informe anual sobre remuneraciones de los conejeros y la reelección de la consultora PricewaterhouseCoopers para auditar las cuentas del grupo.
26 mayo 2017
PharmaMar . Ahora Hay Argumentos que Permiten Pensar en un Cambio de Tendencia Que Va Más Allá del Corto, Medio Plazo ... Un Presente Estable y Futuro Prometedor .
Las Algas de Pharmamar Enfiladas al Ibex .
Pepe Varela - 25/05/2017 .
Ésta es la historia de un alga con propiedades antitumorales que vivía en el fondo del mar; que se sentó en la mesa del IBEX35; que perdió su sitio en esa mesa y que, ahora, quiere volver a sentarse en ella. Esta es la historia de Pharmamar, el laboratorio español responsable de sacar al mercado -entre otros productos- Yondelis, el primer antitumoral de origen marino patentado a nivel mundial (año 2003) para el tratamiento de los sarcomas de tejidos blandos.
Bajar al fondo de mar, buscar entre los miles de plantas que allí habitan y, recolectar, entre ellas, una que curara el cáncer. ¿A quién se le podría ocurrir una idea así? Es, como se dice coloquialmente, buscar una aguja en un pajar (sin saber muy bien si se iba a dar con la dichosa aguja). Sin embargo, José María Fernández Sousa, presidente de la compañía Pharmamar, tenía muy claro que la aguja (el alga) estaba allí. Sólo había que dar con ella y Fernández Sousa, doctor en bioquímica, tenía otra certeza metida entre ceja y ceja: el descubridor iba a hacer mucho dinero con ese hallazgo. El resto es historia: se dio con la Ecteinascidia turbinata, un alga que vive en las zonas tropicales y subtropicales del Atlántico, desde las costas mediterráneas hasta el norte del Brasil y la región caribeña; se extrajo de ella la trabectedina y, por último, se utilizó la sustancia extraída para elaborar el medicamento Yondelis.

Del Yondelis a la Trabectedina .
Luis Mora es Director General de la unidad de oncología de Pharmamar. Por lo tanto, es el interlocutor perfecto para explicar tanto, cómo fue el proceso que transformó la trabectedina en Yondelis, como, también, cómo Pharmamar ha logrado reunir la mayor librería de muestras marinas de todo el mundo “tenemos alrededor de 200.000 muestras. Estas muestras son el origen del descubrimiento de nuevos fármacos como Yondelis”. El camino recorrido se explica en pocas palabras. Otra cosa es recorrerlo, lo que suele suponer muchos años y dinero.
En el caso de Yondelis, hay dos cifras contundentes: 17 años de investigaciones y 110 millones de euros. Luis Mora explica que “en ese camino, lo primero que se hace es iniciar un proceso de búsqueda, descubrimiento e investigación de moléculas que podrían tener actividad antitumoral. Luego, la siguiente fase consiste en averiguar si puedo replicar, o no, esa estructura química en el laboratorio. Si es que no, se pararía la investigación. Si es que sí, hay que darle al compuesto una forma farmacéutica para que pueda ser administrada, primero en animales para, luego, pasar al desarrollo clínico que hacemos en hospitales. Esta es la fase más cara y larga”.
Hasta quince años de búsqueda… hasta llegar a la Farmacia.
¡Ay¡ los ensayos clínicos, esa parte del desarrollo de un medicamente en el que el tiempo y las fases corren a la velocidad de un caracol y el dinero simplemente parece esfumarse, fruto de las altas inversiones a realizar… y, sin que se vea retorno alguno para ya mismo (y puede que para nunca). Mora lo detalla “Los ensayos clínicos constan de tres fases. La fase 1, donde vamos a buscar la dosis que se puede administrar a los pacientes y la frecuencia con la que se va a administrar. La fase dos, donde se va a ver la actividad que tiene ese fármaco, frente a diversos procesos tumorales. Por último, la fase tres, que es donde se va a comparar el fármaco con terapias ya existentes para ese tipo tumoral al que va a dirigido ese fármaco. El tiempo medio de todo este proceso puede ser 12/15 años”.
Vale, ya tenemos el medicamento metido en su bote y en su cajita. Ahora, para darle rentabilidad a la inversión, hay que intentar llevarlo hasta el último rincón del planeta… en el que puedan pagarlo.
Comienzan los problemas .
Es evidente que para que un producto sea un éxito de ventas tiene que ser llevado allá donde estén sus clientes potenciales. A estos efectos, un antitumoral como Yondelis en nada se diferencia a un coche, una naranja o una lavadora. En este caso, el 81% del mercado mundial de medicamentos antitumorales se lo reparten entre Europa y Estados Unidos: un 48% para Estados Unidos, por un 33% para Europa. O sea que, el Yondelis, como cualquier otro medicamento, necesitaba llegar a los clientes (pacientes) de estos grandes mercados si quería convertir en beneficios todo lo gastado. Y para conseguirlo, en mercados regulados como el europeo o el norteamericano, se necesitaba la aprobación tanto de la Agencia Europea del Medicamento (EMEA) cómo, al otro lado del Atlántico, de la Agencia Americana del Medicamento (FDA, en sus siglas en inglés). Aquí es donde comienzan los problemas para Pharmamar.
Año 2003. Primer varapalo. Un ensayo llevado a cabo entre 189 pacientes, que comparaba Yondelis con un placebo -y que incrementó, en un 30%, la supervivencia de los que tomaron Yondelis sobre los que no- no fue suficiente argumento para los evaluadores europeos de la EMEA. Rechazo inicial y posterior aprobación. Año 2011. La FDEA solicita un estudio adicional antes de dar luz verde definitiva al uso de Yondelis frente a otro tipo de tumor, en este caso, el que provoca cáncer de ovario. Rechazo inicial y posterior aprobación. Así que aunque, en ambos casos, el medicamento conseguiría las correspondientes autorizaciones, el daño bursátil para Pharmamar ya estaba hecho: sus acciones se convirtieron en un valor vaivén.
Pharmamar se sube a la Montaña Rusa .
O, lo que es lo mismo, de llegar a pagarse por una acción de Pharmamar casi 20 euros, se pasó a 1,72. Ya se sabe: el dinero es cobarde y poco amigo de las emociones fuertes (en otras palabras, que prefiere, millones de veces, disfrutar de la aburrida placidez del tiovivo que de la excitante adrenalina de la Montaña Rusa). Y a Pharmamar no le han faltado emociones en su proceso de salida a Bolsa; entrada en el selectivo Ibex-35; todo el proceso desarrollado en torno a su fármaco estrella Yondelis; los fuertes movimientos especulativos que comenzaron con el milenio y que, de momento, parecen haber terminado; salida del Ibex-35…
Que ahora el valor de la compañía haya remontado hasta el actual 3,85, parece indicar que tiene, por delante, un recorrido prometedor y de futuro por hacer. Aunque con Pharmamar nunca se sabe. De momento, su valor bursátil ha roto la directriz bajista que traía desde el año 2000. Carlos Doblado, analista técnico y fundador de Ágora Asesores Financieros, explica los porqués “El valor toca su suelo en 2012 y, a partir de esa fecha, la empresa inicia un proceso de recuperación.
Ahora hay argumentos que permiten pensar en un cambio de tendencia que va más allá del corto, medio plazo. El proceso se ha ido asentando y, en las últimas sesiones, con la superación del 3,20, se ha producido un cambio de tendencia más allá del corto o medio plazo. Estaríamos empezando un ciclo que podría tener una duración de meses e, incluso, de años. A partir de ahí, un analista técnico como yo dejaría correr la acción, la seguiría, la estudiaría y, mientras el valor siguiera subiendo de forma recurrente, con sus correcciones, no se inquietaría.” A partir de estos argumentos, Doblado sólo ve, a corto plazo, una sola incertidumbre para el valor “el valor tiene una zona muy importante de dificultad que nosotros llamamos resistencia, y que, en el caso de Pharmamar, en el 4,40. Si el valor superara estas resistencias, creemos que alcanzaría la zona de 6 sin demasiadas dificultades”.
Presente Estable y Futuro Prometedor .
Que el valor Pharmamar haya encontrado este repunte alcista no es casual. Después de años de malas noticias, las buenas nuevas comenzaron a llegar al cuartel general de la compañía en Colmenar Viejo (Madrid). Noticias como que, a finales del año pasado, la empresa firmó un acuerdo de licencia con la farmacéutica surcoreana Boryung Pharm, con el objetivo de comercializar, Aplidin, otro compuesto antitumoral de origen marino. En este caso se trata de la plitidepsina, indicado para el tratamiento de Mieloma Múltiple. Además, por aquellas mismas fechas, el laboratorio rubricó otro acuerdo con Chugai, filial de Roche, para licenciar su antitumoral PM1183 en Japón. Este medicamento está especialmente indicado para cáncer de ovario resistente a platino y cáncer de pulmón microcítico.
Con todas estas buenas noticias -y las que puedan llegar, como las autorizaciones para comercializar estos nuevos compuestos en EE UU o Europa, o el establecimiento de una red propia de distribución en el mercado USA- Pharmamar y sus algas quieren volver a sentarse en la mesa del IBEX… y ser invitadas, más pronto que tarde, a hacerlo en la Bolsa de Nueva York. Pero una cosa son los deseos y otra la realidad… y, sobre este particular, Roberto Moro, analista técnico de Apta Negocios, tiene una doble visión. Con respecto al IBEX “al final todo dependerá de lo que opinen los expertos de revisión del selectivo, pero probablemente, el valor Pharmamar ya esté preparado para ese retorno. Y es que no es lo mismo cotizar, como cotizaba en 2016, a 1,80 euros por acción, que hacerlo a 3,85 y con unos volúmenes sensiblemente superiores”. Harina de otro costal es, según el analista, el caso de Nueva York “en este caso, yo creo que Pharmamar aún no está preparada.”.

Ya se sabe que las buenas noticias atraen a los inversores -de igual manera que las malas les espantan-. En este sentido, buenas nuevas como que Pharmamar haya firmado un acuerdo con el laboratorio Specialised Therapeutics Asia (STA), para comercializar su antitumoral de origen marino PM1183 en 15 países asiáticos, sin duda que empujará hacia arriba el valor bursátil de Pharmamar. ¿Volverán los gloriosos buenos tiempos que auparon a la acción de Pharmamar hasta los 20 euros por acción? Quien lo puede decir… pero, de momento, la cosa no pinta mal.
Pepe Varela - 25/05/2017 .
Ésta es la historia de un alga con propiedades antitumorales que vivía en el fondo del mar; que se sentó en la mesa del IBEX35; que perdió su sitio en esa mesa y que, ahora, quiere volver a sentarse en ella. Esta es la historia de Pharmamar, el laboratorio español responsable de sacar al mercado -entre otros productos- Yondelis, el primer antitumoral de origen marino patentado a nivel mundial (año 2003) para el tratamiento de los sarcomas de tejidos blandos.
Bajar al fondo de mar, buscar entre los miles de plantas que allí habitan y, recolectar, entre ellas, una que curara el cáncer. ¿A quién se le podría ocurrir una idea así? Es, como se dice coloquialmente, buscar una aguja en un pajar (sin saber muy bien si se iba a dar con la dichosa aguja). Sin embargo, José María Fernández Sousa, presidente de la compañía Pharmamar, tenía muy claro que la aguja (el alga) estaba allí. Sólo había que dar con ella y Fernández Sousa, doctor en bioquímica, tenía otra certeza metida entre ceja y ceja: el descubridor iba a hacer mucho dinero con ese hallazgo. El resto es historia: se dio con la Ecteinascidia turbinata, un alga que vive en las zonas tropicales y subtropicales del Atlántico, desde las costas mediterráneas hasta el norte del Brasil y la región caribeña; se extrajo de ella la trabectedina y, por último, se utilizó la sustancia extraída para elaborar el medicamento Yondelis.

Del Yondelis a la Trabectedina .
Luis Mora es Director General de la unidad de oncología de Pharmamar. Por lo tanto, es el interlocutor perfecto para explicar tanto, cómo fue el proceso que transformó la trabectedina en Yondelis, como, también, cómo Pharmamar ha logrado reunir la mayor librería de muestras marinas de todo el mundo “tenemos alrededor de 200.000 muestras. Estas muestras son el origen del descubrimiento de nuevos fármacos como Yondelis”. El camino recorrido se explica en pocas palabras. Otra cosa es recorrerlo, lo que suele suponer muchos años y dinero.
En el caso de Yondelis, hay dos cifras contundentes: 17 años de investigaciones y 110 millones de euros. Luis Mora explica que “en ese camino, lo primero que se hace es iniciar un proceso de búsqueda, descubrimiento e investigación de moléculas que podrían tener actividad antitumoral. Luego, la siguiente fase consiste en averiguar si puedo replicar, o no, esa estructura química en el laboratorio. Si es que no, se pararía la investigación. Si es que sí, hay que darle al compuesto una forma farmacéutica para que pueda ser administrada, primero en animales para, luego, pasar al desarrollo clínico que hacemos en hospitales. Esta es la fase más cara y larga”.
Hasta quince años de búsqueda… hasta llegar a la Farmacia.
¡Ay¡ los ensayos clínicos, esa parte del desarrollo de un medicamente en el que el tiempo y las fases corren a la velocidad de un caracol y el dinero simplemente parece esfumarse, fruto de las altas inversiones a realizar… y, sin que se vea retorno alguno para ya mismo (y puede que para nunca). Mora lo detalla “Los ensayos clínicos constan de tres fases. La fase 1, donde vamos a buscar la dosis que se puede administrar a los pacientes y la frecuencia con la que se va a administrar. La fase dos, donde se va a ver la actividad que tiene ese fármaco, frente a diversos procesos tumorales. Por último, la fase tres, que es donde se va a comparar el fármaco con terapias ya existentes para ese tipo tumoral al que va a dirigido ese fármaco. El tiempo medio de todo este proceso puede ser 12/15 años”.
Vale, ya tenemos el medicamento metido en su bote y en su cajita. Ahora, para darle rentabilidad a la inversión, hay que intentar llevarlo hasta el último rincón del planeta… en el que puedan pagarlo.
Comienzan los problemas .
Es evidente que para que un producto sea un éxito de ventas tiene que ser llevado allá donde estén sus clientes potenciales. A estos efectos, un antitumoral como Yondelis en nada se diferencia a un coche, una naranja o una lavadora. En este caso, el 81% del mercado mundial de medicamentos antitumorales se lo reparten entre Europa y Estados Unidos: un 48% para Estados Unidos, por un 33% para Europa. O sea que, el Yondelis, como cualquier otro medicamento, necesitaba llegar a los clientes (pacientes) de estos grandes mercados si quería convertir en beneficios todo lo gastado. Y para conseguirlo, en mercados regulados como el europeo o el norteamericano, se necesitaba la aprobación tanto de la Agencia Europea del Medicamento (EMEA) cómo, al otro lado del Atlántico, de la Agencia Americana del Medicamento (FDA, en sus siglas en inglés). Aquí es donde comienzan los problemas para Pharmamar.
Año 2003. Primer varapalo. Un ensayo llevado a cabo entre 189 pacientes, que comparaba Yondelis con un placebo -y que incrementó, en un 30%, la supervivencia de los que tomaron Yondelis sobre los que no- no fue suficiente argumento para los evaluadores europeos de la EMEA. Rechazo inicial y posterior aprobación. Año 2011. La FDEA solicita un estudio adicional antes de dar luz verde definitiva al uso de Yondelis frente a otro tipo de tumor, en este caso, el que provoca cáncer de ovario. Rechazo inicial y posterior aprobación. Así que aunque, en ambos casos, el medicamento conseguiría las correspondientes autorizaciones, el daño bursátil para Pharmamar ya estaba hecho: sus acciones se convirtieron en un valor vaivén.
Pharmamar se sube a la Montaña Rusa .
O, lo que es lo mismo, de llegar a pagarse por una acción de Pharmamar casi 20 euros, se pasó a 1,72. Ya se sabe: el dinero es cobarde y poco amigo de las emociones fuertes (en otras palabras, que prefiere, millones de veces, disfrutar de la aburrida placidez del tiovivo que de la excitante adrenalina de la Montaña Rusa). Y a Pharmamar no le han faltado emociones en su proceso de salida a Bolsa; entrada en el selectivo Ibex-35; todo el proceso desarrollado en torno a su fármaco estrella Yondelis; los fuertes movimientos especulativos que comenzaron con el milenio y que, de momento, parecen haber terminado; salida del Ibex-35…
Que ahora el valor de la compañía haya remontado hasta el actual 3,85, parece indicar que tiene, por delante, un recorrido prometedor y de futuro por hacer. Aunque con Pharmamar nunca se sabe. De momento, su valor bursátil ha roto la directriz bajista que traía desde el año 2000. Carlos Doblado, analista técnico y fundador de Ágora Asesores Financieros, explica los porqués “El valor toca su suelo en 2012 y, a partir de esa fecha, la empresa inicia un proceso de recuperación.
Ahora hay argumentos que permiten pensar en un cambio de tendencia que va más allá del corto, medio plazo. El proceso se ha ido asentando y, en las últimas sesiones, con la superación del 3,20, se ha producido un cambio de tendencia más allá del corto o medio plazo. Estaríamos empezando un ciclo que podría tener una duración de meses e, incluso, de años. A partir de ahí, un analista técnico como yo dejaría correr la acción, la seguiría, la estudiaría y, mientras el valor siguiera subiendo de forma recurrente, con sus correcciones, no se inquietaría.” A partir de estos argumentos, Doblado sólo ve, a corto plazo, una sola incertidumbre para el valor “el valor tiene una zona muy importante de dificultad que nosotros llamamos resistencia, y que, en el caso de Pharmamar, en el 4,40. Si el valor superara estas resistencias, creemos que alcanzaría la zona de 6 sin demasiadas dificultades”.
Presente Estable y Futuro Prometedor .
Que el valor Pharmamar haya encontrado este repunte alcista no es casual. Después de años de malas noticias, las buenas nuevas comenzaron a llegar al cuartel general de la compañía en Colmenar Viejo (Madrid). Noticias como que, a finales del año pasado, la empresa firmó un acuerdo de licencia con la farmacéutica surcoreana Boryung Pharm, con el objetivo de comercializar, Aplidin, otro compuesto antitumoral de origen marino. En este caso se trata de la plitidepsina, indicado para el tratamiento de Mieloma Múltiple. Además, por aquellas mismas fechas, el laboratorio rubricó otro acuerdo con Chugai, filial de Roche, para licenciar su antitumoral PM1183 en Japón. Este medicamento está especialmente indicado para cáncer de ovario resistente a platino y cáncer de pulmón microcítico.
Con todas estas buenas noticias -y las que puedan llegar, como las autorizaciones para comercializar estos nuevos compuestos en EE UU o Europa, o el establecimiento de una red propia de distribución en el mercado USA- Pharmamar y sus algas quieren volver a sentarse en la mesa del IBEX… y ser invitadas, más pronto que tarde, a hacerlo en la Bolsa de Nueva York. Pero una cosa son los deseos y otra la realidad… y, sobre este particular, Roberto Moro, analista técnico de Apta Negocios, tiene una doble visión. Con respecto al IBEX “al final todo dependerá de lo que opinen los expertos de revisión del selectivo, pero probablemente, el valor Pharmamar ya esté preparado para ese retorno. Y es que no es lo mismo cotizar, como cotizaba en 2016, a 1,80 euros por acción, que hacerlo a 3,85 y con unos volúmenes sensiblemente superiores”. Harina de otro costal es, según el analista, el caso de Nueva York “en este caso, yo creo que Pharmamar aún no está preparada.”.

Ya se sabe que las buenas noticias atraen a los inversores -de igual manera que las malas les espantan-. En este sentido, buenas nuevas como que Pharmamar haya firmado un acuerdo con el laboratorio Specialised Therapeutics Asia (STA), para comercializar su antitumoral de origen marino PM1183 en 15 países asiáticos, sin duda que empujará hacia arriba el valor bursátil de Pharmamar. ¿Volverán los gloriosos buenos tiempos que auparon a la acción de Pharmamar hasta los 20 euros por acción? Quien lo puede decir… pero, de momento, la cosa no pinta mal.
Spanish Drugmaker PharmaMar (MC: PHM) has entered a licensing agreement with Eczacıbaşı Group to commercialize the marine-derived anticancer drug Aplidin (plitidepsin) in Turkey.
Valoración Link Securities:
Acuerdo positivo para PHM que consigue la expansión en la comercialización de sus productos, alcanzando un mayor número de clientes potenciales, y nuevas fuentes de ingresos sin necesidad de invertir en una red comercial.
El valor lo debe recoger hoy de forma positiva.
Acuerdo positivo para PHM que consigue la expansión en la comercialización de sus productos, alcanzando un mayor número de clientes potenciales, y nuevas fuentes de ingresos sin necesidad de invertir en una red comercial.
El valor lo debe recoger hoy de forma positiva.
25 mayo 2017
PharmaMar y Eczacıbaşı Firman Acuerdo de Licencia para Comercializar Aplidin en Turquía ... " Las Dos Partes Esperan Poder Volver a Ser Socios con Productos Innovadores Para Otros Tipos de Cáncer ".
 Madrid a 25 de Mayo 2017 .
Madrid a 25 de Mayo 2017 .PharmaMar ha anunciado hoy un acuerdo de licencia con la compañía Eczacıbaşı Group para comercializar el compuesto antitumoral de origen marino Aplidin® (plitidepsina) en Turquía. Según los términos del acuerdo, PharmaMar recibirá un pago por adelantado por la firma del contrato además de pagos recurrentes por los hitos regulatorios alcanzados con Aplidin® en este país. PharmaMar conservará los derechos de producción en exclusiva y suministrará el producto a Eczacıbaşı para su uso comercial.
Aplidin® es el segundo fármaco más avanzado en desarrollo por PharmaMar y se encuentra en investigación para tratar el mieloma múltiple y el linfoma de células T angioinmunoblástico. La Compañía anunció en marzo de 2016 que el ensayo clínico de Fase III (ADMYRE) con plitidepsina obtuvo resultados positivos para el tratamiento del mieloma múltiple y en septiembre de 2016 presentó ante la Agencia Europea de Medicamentos (EMA) la solicitud de autorización de comercialización en combinación con dexametasona para el tratamiento de esta patología .
“La alianza con Eczacıbaşı contribuirá a la comercialización en Turquía de plitidepsina, desarrollada para combatir enfermedades hematológicas.
Estamos deseando trabajar con una de las compañías líderes en salud en este país”, ha explicado Luis Mora, director general de la Unidad de Negocio de Oncología de PharmaMar. “Nos mantenemos firmes en nuestro compromiso de avanzar en el desarrollo de terapias innovadoras”, ha añadido.
Por su parte, Atalay Gümrah, CEO y presidente de Eczacıbaşı Group, ha comentado que “el acuerdo entre PharmaMar y Eczacıbaşı Pharmaceuticals Marketing (EIP) ofrece un importante avance en la asistencia sanitaria en Turquía, ya que Aplidin® representa la última innovación en el tratamiento contra el cáncer”.
Elif Çelik, vicepresidente ejecutivo de Eczacıbaşı Healthcare Division, ha confirmado que “este acuerdo garantiza que los pacientes con mieloma múltiple en Turquía tendrían acceso al tratamiento más innovador al mismo tiempo que los pacientes en otros países de la Unión Europea”. Además, ha concluido que “las dos partes esperamos poder volver a ser socios con productos innovadores para otros tipos de cáncer”.
Yondelis . Comparison of Quality of Life (QoL) Between Trabectedin/PLD and Standard Platinum-based Therapy in Patients With Platinum Sensitive Recurrent Ovarian, Fallopian Tube and Peritoneal Cancer .
Yondelis Inicia Nuevo Ensayo Clinico . Triple Therapy as First Line Treatment of Advanced Soft Tissue Sarcoma .
Phase 1/2 Study of Safety/Efficacy Using TRABECTEDIN ( Yondelis de PharmaMar ) , IPILIMUMAB ( Yervoy de Bristol Myers ) and NIVOLUMAB ( Opdivo de Bristol Myers ) Triple Therapy as First Line Treatment of Advanced Soft Tissue Sarcoma .

Sponsor :
Sarcoma Oncology Research Center, .
*****************************************
Summary
This is an open label, dose-seeking phase 1/2 study using escalating doses of TRABECTEDIN given intravenously with defined doses of IPILIMUMAB and NIVOLUMAB based on preliminary results of the Checkmate 012 trial for NSCLC (Hellman et al., 2016). For the Phase 1 Part of Study, only previously treated patients will be enrolled. For the Phase 2 Part of Study, previously untreated patients will be enrolled.
Description
I. Dose Escalation Phase 1 of Study: The study will employ the standard "Cohort of Three" design (Storer, 1989). Three patients are treated at each dose level with expansion to six patients per cohort if DLT is observed in one of the three initially-enrolled patients at each dose level. If no DLT occurs after 2 doses, escalation to the next dose level will be permitted. The maximum tolerated dose is defined as the highest safely tolerated dose, where not more than one patient experienced DLT, with the next higher dose level having at least two patients who experienced DLT. Patients in the dose escalation study may continue treatment at their designated dose levels until disease progression or unacceptable toxicity occurs or up to 9 six-week cycles (one year) of therapy (up 18 TRABECTEDIN doses). No intra-patient dose escalation will take place.
Dose of IPILIMUMAB: 1 mg/kg IV over 30 min. q 12 weeks, beginning 2 weeks after first dose of TRABECTEDIN, until disease progression or unacceptable toxicity, up to 5 doses
Dose of NIVOLUMAB: 3 mg/kg over 30 min. q 2 weeks, beginning 2 weeks after first dose of TRABECTEDIN, until disease progression or unacceptable toxicity, up to 26 doses
Dose of TRABECTEDIN: Escalating doses of TRABECTEDIN IV as continuous intravenous infusion (CIV) over 24 hrs) q 3 weeks:
Dose Level I:
1 mg/m2 (n = 3-6); Dose Level II: 1.2 mg/m2 (n=3-6); Dose Level III: 1.5 mg.m2 (n=3-6)
II. Expansion Phase 2 of Study:
Following dose escalation, an additional 22-28 previously untreated patients will receive TRABECTEDIN at the MTD and defined doses of IPILIMUMAB and NIVOLUMAB to assess overall safety and potential efficacy in a greater number of patients. Patients in the expansion phase of the study may continue treatment until significant disease progression (see criteria for discontinuation of therapy) or unacceptable toxicity occurs up to 9 six-week cycles (one year) of therapy.
Surgical Resection:
After one or more treatment cycles, the principal investigator may recommend surgical debulking, complete surgical removal or a biopsy. If residual disease is present either by histopathological examination or by CT scan/MRI, repeat treatment cycles may be given 4 weeks after surgery, if the surgical incision has healed, and if the patient has < grade I toxicity. Resected or biopsied tumors will be analyzed for the effects of this triple therapy on response, and immune cell trafficking in the tumor microenvironment. Fresh and paraffin embedded tissue blocks will be analyzed by FACS for PD-L1 and other biomarkers, including Tregs, CD8+, CD4+ cells etc. Immunohistochemistry for cyclin G1, cyclin D1 and Ki67 will be conducted to determine the tumor's proliferative state. Histopathologic examination for tumor necrosis and mitotic index will also be determined.
Study Design
Conditions Advanced Soft Tissue Sarcoma .
Intervention Trabectedin, Ipilimumab, Nivolumab.
Location Sarcoma Oncology Research Center Santa Monica California United States 90403.
Status Active, not recruiting
Source Sarcoma Oncology Research Center, LLC
***************************************
Farmacos que Intervienen en el Ensayo :
 Ipilimumab ( Yervoy ) es un Anticuerpo Monoclonal (IgG1κ) anti-CTLA-4 completamente humano, producido en células de ovario de hámster chino mediante tecnología de ADN recombinante.
Ipilimumab ( Yervoy ) es un Anticuerpo Monoclonal (IgG1κ) anti-CTLA-4 completamente humano, producido en células de ovario de hámster chino mediante tecnología de ADN recombinante.
YERVOY está indicado para el tratamiento del melanoma avanzado (irresecable o metastásico) en adultos.
****************

Yondelis además de inducir la muerte de las células tumorales, actúa deplecionando los macrófagos asociados al tumor. Estas células, que normalmente forman parte del sistema inmunológico, tienen en el tumor una actividad protumoral ya que liberan una serie de factores que estimulan la división de las células tumorales así como la formación de neovasos.
Al inducir la muerte de éstas células, 'Yondelis' inhibe esta actividad protumoral y disminuye la secreción de los factores estimulantes del crecimiento tumoral. Este mecanismo de acción es particular a 'Yondelis' y no se observa con ninguna de los otros agentes antitumorales estudiados .
*****************
 Nivolumab ( Opdivo ) se produce en células de ovario de hámster chino mediante tecnología de ADN recombinante.
Nivolumab ( Opdivo ) se produce en células de ovario de hámster chino mediante tecnología de ADN recombinante.
Indicaciones :
Melanoma:
OPDIVO en monoterapia o en combinación con ipilimumab está indicado para el tratamiento del melanoma avanzado (irresecable o metastásico) en adultos.
En comparación con nivolumab en monoterapia se ha establecido un aumento de la supervivencia libre de progresión (SLP) para la combinación de nivolumab con ipilimumab, solamente en los pacientes con baja expresión de PD-L1 en el tumor (ver las secciones 4.4 y 5.1).
Cáncer de Pulmón No Microcítico (CPNM) :
OPDIVO está indicado para el tratamiento del cáncer de pulmón no microcítico (CPNM), localmente avanzado o metastásico después de quimioterapia previa, en adultos.
Carcinoma de Células Renales (CCR) :
OPDIVO en monoterapia está indicado para el tratamiento del carcinoma de células renales avanzado después de tratamiento previo, en adultos.
Linfoma de Hodgkin clásico (LHc) :
OPDIVO está indicado para el tratamiento de pacientes adultos con linfoma de Hodgkin clásico (LHc) en recaída o refractario después de un trasplante .

Sponsor :
Sarcoma Oncology Research Center, .
*****************************************
Summary
This is an open label, dose-seeking phase 1/2 study using escalating doses of TRABECTEDIN given intravenously with defined doses of IPILIMUMAB and NIVOLUMAB based on preliminary results of the Checkmate 012 trial for NSCLC (Hellman et al., 2016). For the Phase 1 Part of Study, only previously treated patients will be enrolled. For the Phase 2 Part of Study, previously untreated patients will be enrolled.
Description
I. Dose Escalation Phase 1 of Study: The study will employ the standard "Cohort of Three" design (Storer, 1989). Three patients are treated at each dose level with expansion to six patients per cohort if DLT is observed in one of the three initially-enrolled patients at each dose level. If no DLT occurs after 2 doses, escalation to the next dose level will be permitted. The maximum tolerated dose is defined as the highest safely tolerated dose, where not more than one patient experienced DLT, with the next higher dose level having at least two patients who experienced DLT. Patients in the dose escalation study may continue treatment at their designated dose levels until disease progression or unacceptable toxicity occurs or up to 9 six-week cycles (one year) of therapy (up 18 TRABECTEDIN doses). No intra-patient dose escalation will take place.
Dose of IPILIMUMAB: 1 mg/kg IV over 30 min. q 12 weeks, beginning 2 weeks after first dose of TRABECTEDIN, until disease progression or unacceptable toxicity, up to 5 doses
Dose of NIVOLUMAB: 3 mg/kg over 30 min. q 2 weeks, beginning 2 weeks after first dose of TRABECTEDIN, until disease progression or unacceptable toxicity, up to 26 doses
Dose of TRABECTEDIN: Escalating doses of TRABECTEDIN IV as continuous intravenous infusion (CIV) over 24 hrs) q 3 weeks:
Dose Level I:
1 mg/m2 (n = 3-6); Dose Level II: 1.2 mg/m2 (n=3-6); Dose Level III: 1.5 mg.m2 (n=3-6)
II. Expansion Phase 2 of Study:
Following dose escalation, an additional 22-28 previously untreated patients will receive TRABECTEDIN at the MTD and defined doses of IPILIMUMAB and NIVOLUMAB to assess overall safety and potential efficacy in a greater number of patients. Patients in the expansion phase of the study may continue treatment until significant disease progression (see criteria for discontinuation of therapy) or unacceptable toxicity occurs up to 9 six-week cycles (one year) of therapy.
Surgical Resection:
After one or more treatment cycles, the principal investigator may recommend surgical debulking, complete surgical removal or a biopsy. If residual disease is present either by histopathological examination or by CT scan/MRI, repeat treatment cycles may be given 4 weeks after surgery, if the surgical incision has healed, and if the patient has < grade I toxicity. Resected or biopsied tumors will be analyzed for the effects of this triple therapy on response, and immune cell trafficking in the tumor microenvironment. Fresh and paraffin embedded tissue blocks will be analyzed by FACS for PD-L1 and other biomarkers, including Tregs, CD8+, CD4+ cells etc. Immunohistochemistry for cyclin G1, cyclin D1 and Ki67 will be conducted to determine the tumor's proliferative state. Histopathologic examination for tumor necrosis and mitotic index will also be determined.
Study Design
Conditions Advanced Soft Tissue Sarcoma .
Intervention Trabectedin, Ipilimumab, Nivolumab.
Location Sarcoma Oncology Research Center Santa Monica California United States 90403.
Status Active, not recruiting
Source Sarcoma Oncology Research Center, LLC
***************************************
Farmacos que Intervienen en el Ensayo :
 Ipilimumab ( Yervoy ) es un Anticuerpo Monoclonal (IgG1κ) anti-CTLA-4 completamente humano, producido en células de ovario de hámster chino mediante tecnología de ADN recombinante.
Ipilimumab ( Yervoy ) es un Anticuerpo Monoclonal (IgG1κ) anti-CTLA-4 completamente humano, producido en células de ovario de hámster chino mediante tecnología de ADN recombinante.YERVOY está indicado para el tratamiento del melanoma avanzado (irresecable o metastásico) en adultos.
****************

Yondelis además de inducir la muerte de las células tumorales, actúa deplecionando los macrófagos asociados al tumor. Estas células, que normalmente forman parte del sistema inmunológico, tienen en el tumor una actividad protumoral ya que liberan una serie de factores que estimulan la división de las células tumorales así como la formación de neovasos.
Al inducir la muerte de éstas células, 'Yondelis' inhibe esta actividad protumoral y disminuye la secreción de los factores estimulantes del crecimiento tumoral. Este mecanismo de acción es particular a 'Yondelis' y no se observa con ninguna de los otros agentes antitumorales estudiados .
*****************
 Nivolumab ( Opdivo ) se produce en células de ovario de hámster chino mediante tecnología de ADN recombinante.
Nivolumab ( Opdivo ) se produce en células de ovario de hámster chino mediante tecnología de ADN recombinante.Indicaciones :
Melanoma:
OPDIVO en monoterapia o en combinación con ipilimumab está indicado para el tratamiento del melanoma avanzado (irresecable o metastásico) en adultos.
En comparación con nivolumab en monoterapia se ha establecido un aumento de la supervivencia libre de progresión (SLP) para la combinación de nivolumab con ipilimumab, solamente en los pacientes con baja expresión de PD-L1 en el tumor (ver las secciones 4.4 y 5.1).
Cáncer de Pulmón No Microcítico (CPNM) :
OPDIVO está indicado para el tratamiento del cáncer de pulmón no microcítico (CPNM), localmente avanzado o metastásico después de quimioterapia previa, en adultos.
Carcinoma de Células Renales (CCR) :
OPDIVO en monoterapia está indicado para el tratamiento del carcinoma de células renales avanzado después de tratamiento previo, en adultos.
Linfoma de Hodgkin clásico (LHc) :
OPDIVO está indicado para el tratamiento de pacientes adultos con linfoma de Hodgkin clásico (LHc) en recaída o refractario después de un trasplante .
24 mayo 2017
Sandra Ortega Ha Comprado Acciones en el Mercado por unos 90.000 euros con el objetivo de Mantener el 5 % del Capital .
Sandra Ortega Apuesta por la Oncología y Compra Acciones de PharmaMar .
 SOFÍA VÁZQUEZ // 24/05/2017 .
SOFÍA VÁZQUEZ // 24/05/2017 .
La empresaria gallega Sandra Ortega ha comprado, a través de su brazo inversor Rosp Corunna, acciones de PharmaMar en el mercado por unos 90.000 euros con el objetivo de mantener el 5 % del capital, haciendo así una apuesta clara por la biotecnológica.
En concreto, Ortega adquirió 22.300 acciones a un precio de 3,90 euros por título, y se posiciona como segunda accionista tras el presidente de la compañía, José María Fernández Sousa-Faro.
PharmaMar realizó una ampliación de capital para dar entrada a la firma australiana Specialised Therapeutics Asia (STA), con quien ha firmado un acuerdo para la comercialización del antitumoral de origen marino lurbinectedina (PM1183).
La sustancia está descrita para el tratamiento de distintos tipos de cáncer y STA la comercializará en 12 países asiáticos: Brunei, Camboya, Indonesia, Laos, Malasia, Birmania, Papúa Nueva Guinea, Filipinas, Singapur, Timor Oriental, Tailandia y Vietnam.
La compañía -que ha dado entrada a STA con una ampliación de poco más de dos millones de euros- está considerada por sus inversores como una empresa de gran potencial y se plantea cotizar en el Nasdaq estadounidense, beneficiándose así del poder de los fondos de inversión especializados en biotecnología.
Desde enero se ha revalorizado un 50 % en bolsa.El PM1183 es el tercer antitumoral de origen marino de PharmaMar y en la actualidad se encuentra en fase final de investigación como posible nueva terapia para el tratamiento de distintos tumores.
La empresaria gallega Sandra Ortega ha comprado, a través de su brazo inversor Rosp Corunna, acciones de PharmaMar en el mercado por unos 90.000 euros con el objetivo de mantener el 5 % del capital, haciendo así una apuesta clara por la biotecnológica.
En concreto, Ortega adquirió 22.300 acciones a un precio de 3,90 euros por título, y se posiciona como segunda accionista tras el presidente de la compañía, José María Fernández Sousa-Faro.
PharmaMar realizó una ampliación de capital para dar entrada a la firma australiana Specialised Therapeutics Asia (STA), con quien ha firmado un acuerdo para la comercialización del antitumoral de origen marino lurbinectedina (PM1183).
La sustancia está descrita para el tratamiento de distintos tipos de cáncer y STA la comercializará en 12 países asiáticos: Brunei, Camboya, Indonesia, Laos, Malasia, Birmania, Papúa Nueva Guinea, Filipinas, Singapur, Timor Oriental, Tailandia y Vietnam.
La compañía -que ha dado entrada a STA con una ampliación de poco más de dos millones de euros- está considerada por sus inversores como una empresa de gran potencial y se plantea cotizar en el Nasdaq estadounidense, beneficiándose así del poder de los fondos de inversión especializados en biotecnología.
Desde enero se ha revalorizado un 50 % en bolsa.El PM1183 es el tercer antitumoral de origen marino de PharmaMar y en la actualidad se encuentra en fase final de investigación como posible nueva terapia para el tratamiento de distintos tumores.
Innovación . El Despertar de las ‘ Startups ’ Biotecnológicas .
 Por Jorge G. García .
Por Jorge G. García .Los emprendedores que actúan en este sector han crecido exponencialmente en la última década pese a los escasos o nulos conocimientos empresariales de los científicos .
Madrid 23 MAY 2017 .
La vida del investigador científico está consagrada a mejorar la calidad de vida de la sociedad. Eso conlleva un trabajo ímprobo en los laboratorios que, para muchos investigadores, compensa gracias a la pasión que sienten por la ciencia. Pero, aunque los científicos españoles están muy preparados en sus disciplinas, suelen tener problemas cuando intentan rentabilizar sus descubrimientos. Saben de moléculas, reacciones químicas o propiedades alimenticias, aunque nada de planes de negocio, comunicación o rondas de financiación. Las startups en el sector biotech han crecido con fuerza en la última década y representan un 5% del total de empresas en esta área, según datos de la Asociación Española de Bioempresas (ASEBIO); pero sus carencias en destrezas empresariales son una barrera para crear un producto.
Yolanda González, de 28 años, conoce a la perfección esta sensación. Todavía le falta medio año para terminar su doctorado, financiado por la Asociación Española contra el Cáncer, pero ya se ha adentrado en el mundo de las startup. En 2016, obtuvo el primer premio del programa Yuzz del Banco Santander por Nanocore Biotech. Esta empresa que, como ella asegura, le sirvió para salir de la universidad y adentrarse en la industria, parte de su investigación en oncología infantil para evitar que los fármacos contra el cáncer ataquen células sanas y no tumorales. “En mi carrera nadie hablaba de emprender y ahora entiendo todo lo que es gracias al programa Yuzz. Si ni siquiera sabía vender mi idea, cómo me iba a plantear buscar dinero”, explica González.
Esta sensación de vivir inmerso solo en un laboratorio también la comparte Roi Villar, presidente de ComunicaBiotech. Reconoce que ya existen algunos emprendedores con alta cualificación empresarial en el sector, pero la mayoría son solo científicos. Aun con esta rémora, Villar ahonda en el tema financiero y económico como otra gran barrera olvidada. “Las startup en biotech son devoradoras de capital. Antes de poder facturar, cuando se encuentran todavía en fase de pruebas clínicas, pueden necesitar desde 500.000 euros hasta 30 millones”, argumenta.
...
23 mayo 2017
Efficacy of Trabectedin in Patients With Advanced Translocation-Related Sarcomas : Pooled Analysis of Two Phase II Studies.
The Official Journal of the Society for Tralational Oncology .
The Oncologist first published on May 18, 2017 .
 Shizuoka Cancer Center Hospital, Shizuoka, Japan .
Shizuoka Cancer Center Hospital, Shizuoka, Japan .
Abstract // BACKGROUND :
Trabectedin is reported as effective, especially against translocation-related sarcomas (TRSs) after failure of or intolerance to standard chemotherapy. We conducted two phase II studies of TRS, confirming high efficacy of 1.2 mg/m2 trabectedin. The updated data of 66 patients in these studies was integrated to evaluate the efficacy of trabectedin against each histological subtype, and analyze final overall survival (OS).
...
CONCLUSION:
Our updated and pooled data showed that trabectedin exerted prolonged disease control and antitumor effects in patients with advanced TRS, especially in MRCL. We consider that the subgroup analyses also provide important information for trabectedin treatment in patients with TRS.
IMPLICATIONS FOR PRACTICE:
The progression-free survival (PFS) for the integrated data of 66 patients with translocation-related sarcomas (TRSs) in two phase II studies of trabectedin 1.2 mg/m2 was 5.6 months (95% confidence interval: 4.1-7.3). PFS and response rate in myxoid/round-cell liposarcoma was longer than that of other subtypes. The overall survival (OS) in all TRS subtypes was similar to previous data of TRS patients. In subgroup analysis, the patients with baseline lymphocyte count ≥1,000/μL exhibited better OS, although PFS was not different by baseline lymphocyte count. Our data are considered important information for trabectedin treatment in TRS patients.
© 2017 The Authors The Oncologist published by Wiley Periodicals, Inc. on behalf of AlphaMed Press.
The Oncologist first published on May 18, 2017 .
 Shizuoka Cancer Center Hospital, Shizuoka, Japan .
Shizuoka Cancer Center Hospital, Shizuoka, Japan .Abstract // BACKGROUND :
Trabectedin is reported as effective, especially against translocation-related sarcomas (TRSs) after failure of or intolerance to standard chemotherapy. We conducted two phase II studies of TRS, confirming high efficacy of 1.2 mg/m2 trabectedin. The updated data of 66 patients in these studies was integrated to evaluate the efficacy of trabectedin against each histological subtype, and analyze final overall survival (OS).
...
CONCLUSION:
Our updated and pooled data showed that trabectedin exerted prolonged disease control and antitumor effects in patients with advanced TRS, especially in MRCL. We consider that the subgroup analyses also provide important information for trabectedin treatment in patients with TRS.
IMPLICATIONS FOR PRACTICE:
The progression-free survival (PFS) for the integrated data of 66 patients with translocation-related sarcomas (TRSs) in two phase II studies of trabectedin 1.2 mg/m2 was 5.6 months (95% confidence interval: 4.1-7.3). PFS and response rate in myxoid/round-cell liposarcoma was longer than that of other subtypes. The overall survival (OS) in all TRS subtypes was similar to previous data of TRS patients. In subgroup analysis, the patients with baseline lymphocyte count ≥1,000/μL exhibited better OS, although PFS was not different by baseline lymphocyte count. Our data are considered important information for trabectedin treatment in TRS patients.
© 2017 The Authors The Oncologist published by Wiley Periodicals, Inc. on behalf of AlphaMed Press.
Yondelis combinado con Avelumab (Bavencio) ( Fase I-II ) . First Extensive Immune Profiling of Sarcomas Shows Possible Susceptibility to Immunotherapy .
By The ASCO Post // Posted : 5 / 22 / 2017 .

... Ongoing Study
Dr. Pollack is conducting ongoing clinical trials combining chemotherapies and checkpoint inhibitors in patients with metastatic or unresectable sarcomas—one focusing on pembrolizumab (Keytruda) and doxorubicin hydrochloride combination treatment and the other studying the combination of avelumab (Bavencio) and trabectedin (Yondelis).
Ultimately, he hopes to expand treatment options for patients with advanced sarcoma, who have an estimated survival of 12 to 18 months.
The Sarcoma Alliance for Research through Collaboration, the Sarcoma Foundation for America, and the Gilman Sarcoma Foundation funded the research.
The content in this post has not been reviewed by the American Society of Clinical Oncology, Inc. (ASCO®) and does not necessarily reflect the ideas and opinions of ASCO®.
...

... Ongoing Study
Dr. Pollack is conducting ongoing clinical trials combining chemotherapies and checkpoint inhibitors in patients with metastatic or unresectable sarcomas—one focusing on pembrolizumab (Keytruda) and doxorubicin hydrochloride combination treatment and the other studying the combination of avelumab (Bavencio) and trabectedin (Yondelis).
Ultimately, he hopes to expand treatment options for patients with advanced sarcoma, who have an estimated survival of 12 to 18 months.
The Sarcoma Alliance for Research through Collaboration, the Sarcoma Foundation for America, and the Gilman Sarcoma Foundation funded the research.
The content in this post has not been reviewed by the American Society of Clinical Oncology, Inc. (ASCO®) and does not necessarily reflect the ideas and opinions of ASCO®.
...
Myxoid Liposarcoma . Consideration Should be Given to Using Trabectedin before other Salvage Regimens like Gemcitabine and Docetaxel, Given its Tolerability and Excellent Efficacy against this Sarcoma Subtype.
The Sequencing of Trabectedin with other Agents is also Worth Examining.
 Authors : Ravin Ratan / Shreyaskumar R. Patel .
Authors : Ravin Ratan / Shreyaskumar R. Patel .
Sarcoma (SH Okuno, Section Editor) /// First Online: 22 May 2017 .
Trabectedin and eribulin are two agents that have been recently approved for the treatment of specific soft tissue sarcoma subtypes.
They have proved to be a much-needed line of additional treatment for patients with these rare tumors, but their activity remains admittedly modest in most cases.
Further exploitation of these novel agents is likely to require a more granular understanding of the salient mechanisms of action.
For example, if as some studies suggest, eribulin derives its benefit from restructuring of tumor vasculature to improve efficacy of subsequent lines of therapy, then patients may benefit from its use earlier in the treatment pathway.
The sequencing of trabectedin with other agents is also worth examining. In a disease like myxoid liposarcoma, consideration should be given to using trabectedin before other salvage regimens like gemcitabine and docetaxel, given its tolerability and excellent efficacy against this sarcoma subtype.
 Also, to be further investigated is the use of trabectedin in sarcoma subtypes which were excluded from the phase III study, but in which activity has been documented in earlier trials and subsequent reports. Combinations of trabectedin with other agents, particularly doxorubicin, have been explored, but the data to date do not support the routine use of these regimens.
Also, to be further investigated is the use of trabectedin in sarcoma subtypes which were excluded from the phase III study, but in which activity has been documented in earlier trials and subsequent reports. Combinations of trabectedin with other agents, particularly doxorubicin, have been explored, but the data to date do not support the routine use of these regimens.
**********************
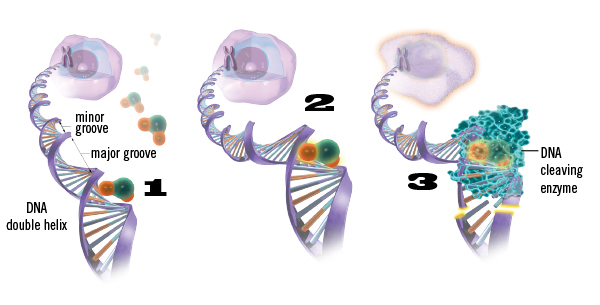
YONDELIS was originally made from sea squirts, or the marine organism Ecteinascidia turbinata. It works by stopping the abnormal multiplication of cancer cells within the body that would otherwise spread, destroying nearby tissues. It does this by binding to and damaging the DNA in cancer cells, causing the cells to die.
 Authors : Ravin Ratan / Shreyaskumar R. Patel .
Authors : Ravin Ratan / Shreyaskumar R. Patel .Sarcoma (SH Okuno, Section Editor) /// First Online: 22 May 2017 .
Trabectedin and eribulin are two agents that have been recently approved for the treatment of specific soft tissue sarcoma subtypes.
They have proved to be a much-needed line of additional treatment for patients with these rare tumors, but their activity remains admittedly modest in most cases.
Further exploitation of these novel agents is likely to require a more granular understanding of the salient mechanisms of action.
For example, if as some studies suggest, eribulin derives its benefit from restructuring of tumor vasculature to improve efficacy of subsequent lines of therapy, then patients may benefit from its use earlier in the treatment pathway.
The sequencing of trabectedin with other agents is also worth examining. In a disease like myxoid liposarcoma, consideration should be given to using trabectedin before other salvage regimens like gemcitabine and docetaxel, given its tolerability and excellent efficacy against this sarcoma subtype.
 Also, to be further investigated is the use of trabectedin in sarcoma subtypes which were excluded from the phase III study, but in which activity has been documented in earlier trials and subsequent reports. Combinations of trabectedin with other agents, particularly doxorubicin, have been explored, but the data to date do not support the routine use of these regimens.
Also, to be further investigated is the use of trabectedin in sarcoma subtypes which were excluded from the phase III study, but in which activity has been documented in earlier trials and subsequent reports. Combinations of trabectedin with other agents, particularly doxorubicin, have been explored, but the data to date do not support the routine use of these regimens.**********************
YONDELIS was originally made from sea squirts, or the marine organism Ecteinascidia turbinata. It works by stopping the abnormal multiplication of cancer cells within the body that would otherwise spread, destroying nearby tissues. It does this by binding to and damaging the DNA in cancer cells, causing the cells to die.
Especialistas encontraron un Anticuerpo que puede influir en las Células T reguladoras para que hagan que el sistema inmune ‘aniquile’ las células cancerosas ... disminuyó el crecimiento tumoral en los modelos de melanoma, glioblastoma y carcinoma colorrectal .
 22 MAYO, 2017 .
22 MAYO, 2017 .Investigadores del Brigham and Women’s Hospital de EE.UU. estudiaban las bases teóricas de la esclerosis múltiple cuando accidentalmente realizaron un importante descubrimiento para el tratamiento de cáncer. El estudio que lo describe ha sido publicado en la revista ‘Science Immunology’.
De acuerdo con Eureka Alert!, los especialistas encontraron un anticuerpo que puede influir en las células T reguladoras para que hagan que el sistema inmune ‘aniquile’ las células cancerosas. Este anticuerpo, según el equipo liderado por el neurólogo Howard Weiner, disminuyó el crecimiento tumoral en los modelos de melanoma, glioblastoma y carcinoma colorrectal, por lo que se estima como promisorio en la inmunoterapia de esta enfermedad mortal.
“Como neurólogo, nunca esperé publicar un artículo sobre la inmunoterapia contra el cáncer”, explica Weiner. “Pero ya que mi equipo estudió una subpoblación de células T que se supone que previenen la enfermedad autoinmune, tuvimos una idea: si el cáncer es lo contrario a una enfermedad autoinmune, podríamos cambiar nuestras investigaciones y pensar en cómo restaurar la capacidad del sistema inmune para prevenir el crecimiento del cáncer”.
Las células T reguladoras pueden, inadvertidamente, promover el crecimiento del cáncer al prevenir que el sistema inmunológico detecte y ataque las células cancerosas, explican los investigadores. Los anticuerpos conocidos como anti-LAP, por su parte, son capaces de bloquear los mecanismos esenciales de las células T y restaurar la capacidad del sistema inmune para luchar contra el cáncer.
22 mayo 2017
PharmaMar se Presenta con Todos sus Logros y Espectativas Ante Analistas ... Bancos ... Inversores Públicos y Privados ... en la BIO€QUITY EUROPE 2017 que tendra lugar el 22 y 23 de Mayo en Paris .
 PharmaMar’s COO Pascal Besman at BioEquity Europe 2017 : Advice and Q&A on how to position your company to global investors .
PharmaMar’s COO Pascal Besman at BioEquity Europe 2017 : Advice and Q&A on how to position your company to global investors .
BIO EQUITY EUROPE 2017 Reúne a Inversores Privados y Públicos, Bancos y Analistas, con Empresas Biotecnológicas de toda Europa, con el Objetivo de Expandir los Mercados de Capitales, para su Inversión en el Sector de Ciencias de la Vida en Europa.
Bio€quity Europe pioneered the turf-neutral concept, creating an open door for all members of the financial community and business development and licensing professionals to do business with independently selected Presenting Companies.
Now celebrating its 18th meeting, Bio€quity Europe is the seminal industry event for financial dealmakers looking for investor-validated life science companies positioning themselves to attract capital, and for pharmaceutical licensing professionals to assess top prospects. Bio€quity Europe has showcased more than 700 leading European companies to thousands of investment and pharma business development professionals. Delegates from 24 nations attended Bio€quity Europe last year in Copenhagen.
LOCATION:
Marriott Rive Gauche .
17 Boulevard Saint Jacques .
Paris 75014 France
DATE:
May 22 - 23, 2017 .
**************************
Bio€quity Europe 2017 will be anchored by more than 80 investor-validated Presenting and Next Wave Companies.
The financial community recognizes that the Presenting Companies are independently chosen by BioCentury based on rigorous criteria, including fundraising validation and upcoming milestones informed by the intelligence of the conference's leading sponsors.
21 mayo 2017
Cáncer de Mama . Una experta señala que dicho tipo de Cáncer afecta "cada vez a edades más tempranas" .
La doctora María Martínez, especialista en Radiodiagnóstico, insiste en que una mastectomía no reduce al 100% el riesgo de sufrir esta enfermedad .
E. P. 21.05.2017 | 10:36
La doctora María Martínez, especialista en Radiodiagnóstico y directora de la Unidad de Mama del Hospital Mesa del Castillo de Murcia, destaca que el cáncer de mama ha cambiado su perfil de incidencia "porque cada vez lo vemos a edades más tempranas" y que el pronóstico precoz es deseable, "pero no hay indicadores que avalen la obligación de implantar un cribado mamográfico poblacional a edades tempranas".
Así, señaló que este aumento del cáncer de mama en mujeres jóvenes tiene "mucho que ver confactores ambientales y genéticos", y destacó la importancia de hacer ejercicio físico, mantener un peso adecuado y una dieta mediterránea y evitar el consumo de tabaco y alcohol. "Pero son consejos, factores protectores pero no causa directa; esto no significa que no se desarrolle el cáncer de mama", resaltó en una entrevista.
Y es que, hizo hincapié, "la grasa es el factor convertidor de estrógenos cuando el ovario deja de funcionar, y el cáncer de mama es un cáncer hormonalmente dependiente, la mayor parte de él". Así se considera que "cuando se llega a la edad de mayor incidencia del cáncer y desaparece la influencia ovárica, tener un bajo índice corporal de grasa previene del cáncer", lo que "no significa que sea una mujer mayor, activa y delgada y no le salga". Otro factor "protector" podría ser la lactancia materna, "aunque no es una causa directa".
...
20 mayo 2017
Un cómic para que adultos y niños resuelvan sus dudas sobre el cáncer .
La Fundación CRIS contra esta enfermedad pone en marcha esta iniciativa con el objetivo de que la información rigurosa sea divulgativa .
...

...


Gliobastoma . Científicos estudiarán si el virus Zika puede eliminar células de tumor cerebral .
LONDRES, 19 May. (Reuters/Notimérica) .
 Varios científicos en Gran Bretaña planean utilizar el virus de Zika para intentar eliminar células de tumores cerebrales en experimentos que afirman podrían generar nuevas maneras de luchar contra una agresiva forma de cáncer.
Varios científicos en Gran Bretaña planean utilizar el virus de Zika para intentar eliminar células de tumores cerebrales en experimentos que afirman podrían generar nuevas maneras de luchar contra una agresiva forma de cáncer.
La investigación se centrará en el glioblastoma, el tipo más común de cáncer cerebral, que tiene una tasa de supervivencia a cinco años de apenas el cinco por ciento.
El virus Zika causa graves discapacidades en bebés al atacar las células madre del cerebro en formación, pero en los adultos --cuyos cerebros ya están conformados-- suele generar síntomas leves parecidos a la gripe.
En el Glioblastoma, las células cancerígenas son similares a las presentes en el cerebro en desarrollo, lo que sugiere que el virus podría ser usado para apuntar específicamente a ellas y evitar el tejido cerebral normal. Los expertos dicen que los tratamientos que existen actualmente deben ser aplicados en dos ...
 Varios científicos en Gran Bretaña planean utilizar el virus de Zika para intentar eliminar células de tumores cerebrales en experimentos que afirman podrían generar nuevas maneras de luchar contra una agresiva forma de cáncer.
Varios científicos en Gran Bretaña planean utilizar el virus de Zika para intentar eliminar células de tumores cerebrales en experimentos que afirman podrían generar nuevas maneras de luchar contra una agresiva forma de cáncer. La investigación se centrará en el glioblastoma, el tipo más común de cáncer cerebral, que tiene una tasa de supervivencia a cinco años de apenas el cinco por ciento.
El virus Zika causa graves discapacidades en bebés al atacar las células madre del cerebro en formación, pero en los adultos --cuyos cerebros ya están conformados-- suele generar síntomas leves parecidos a la gripe.
En el Glioblastoma, las células cancerígenas son similares a las presentes en el cerebro en desarrollo, lo que sugiere que el virus podría ser usado para apuntar específicamente a ellas y evitar el tejido cerebral normal. Los expertos dicen que los tratamientos que existen actualmente deben ser aplicados en dos ...
19 mayo 2017
Trabectedin Combined With Durvalumab in Patients With Advanced Pretreated Soft-tissue Sarcomas and Ovarian Carcinomas. (TRAMUNE) .
El Fármaco Nivolumab ( Opdivo ) inhibe ciertas Moleculas lo que permite que el sistema Inmune ataque al Cáncer .
Estamos hablando de Inmunoterapia y del Inicio de Fase I con la combinacion de Yondelis y Nivolumab .
This study is currently recruiting participants.
Verified May 2017 by Institut Bergonié
Sponsor:
Institut Bergonié
Collaborators:
AstraZeneca
PharmaMar
Information provided by (Responsible Party):
Institut Bergonié
ClinicalTrials.gov Identifier:
NCT03085225 .
Last updated: May 12, 2017.
Last verified: May 2017
Edison Otorga a Pharmamar un Potencial de un 75% . Precio Objetivo : 6,75 euros .
PharmaMar Presentará en Estados Unidos los Resultados de Varios Estudios Clínicos de Yondelis y Lurbinectedin.
Redacción / Estrategias de Inversión, 18-05-2017 .

Lo hará durante el 53º congreso de la Sociedad Americana de Oncología Clínica, que se celebrará del 2 al 6 de junio en Chicago (Estados Unidos).
Pero mientras convence a los científicos de sus posibilidades, ya lo ha hecho con los analistas. Al menos con los de la firma Edison.
En un reciente informe enviado a sus clientes, estos analistas han elevado el precio objetivo de PharmaMar un 16%, hasta 6,75 euros por acción, lo que daría a la compañía un potencial de un 75% desde el nivel actual de cotización. Consideran que la biotecnológica española debería tener una capitalización de 1.500 millones de euros.
En su informe explican estos expertos que la compañía pretende comercializar lurbinectedin por su cuenta tanto en Estados Unidos como en Europa. Ellos estiman que la comercialización en América podría costar a la compañía alrededor de 23 millones de dólares al año, una cantidad que podría financiar con su propio cash flow o a través de una emisión de deuda.
Previsiones Pharmamar
Creen que en el segundo año de comercialización esta línea podría alcanzar el nivel de equilibrio operativo (break even) en el segundo año en el que lurbinectedin esté en el mercado.
La mejora de la valoración de la compañía se debe tanto a la previsión de comercialización independiente de este fármaco en Estados Unidos, con lo que podrían obtener un margen operativo del 50% de las ventas netas, frente al 35% que preveían inicialmente.
También valoran positivamente el retraso del primer genérico de Yondelis en Europa hasta 2024, frente a 2022 como se esperaba inicialmente
En lo que va de año, las acciones de PharmaMar suben un 45% en la bolsa de Madrid. Este porcentaje llega hasta el 75% en los doce últimos meses.
Los Indicadores Premium de Estrategias de Inversión sitúan al valor en fase alcista, al otorgarle 9 puntos de los 10 posibles, tal y como puede verse en el gráfico.

Redacción / Estrategias de Inversión, 18-05-2017 .

Lo hará durante el 53º congreso de la Sociedad Americana de Oncología Clínica, que se celebrará del 2 al 6 de junio en Chicago (Estados Unidos).
Pero mientras convence a los científicos de sus posibilidades, ya lo ha hecho con los analistas. Al menos con los de la firma Edison.
En un reciente informe enviado a sus clientes, estos analistas han elevado el precio objetivo de PharmaMar un 16%, hasta 6,75 euros por acción, lo que daría a la compañía un potencial de un 75% desde el nivel actual de cotización. Consideran que la biotecnológica española debería tener una capitalización de 1.500 millones de euros.
En su informe explican estos expertos que la compañía pretende comercializar lurbinectedin por su cuenta tanto en Estados Unidos como en Europa. Ellos estiman que la comercialización en América podría costar a la compañía alrededor de 23 millones de dólares al año, una cantidad que podría financiar con su propio cash flow o a través de una emisión de deuda.
Previsiones Pharmamar
Creen que en el segundo año de comercialización esta línea podría alcanzar el nivel de equilibrio operativo (break even) en el segundo año en el que lurbinectedin esté en el mercado.
La mejora de la valoración de la compañía se debe tanto a la previsión de comercialización independiente de este fármaco en Estados Unidos, con lo que podrían obtener un margen operativo del 50% de las ventas netas, frente al 35% que preveían inicialmente.
También valoran positivamente el retraso del primer genérico de Yondelis en Europa hasta 2024, frente a 2022 como se esperaba inicialmente
En lo que va de año, las acciones de PharmaMar suben un 45% en la bolsa de Madrid. Este porcentaje llega hasta el 75% en los doce últimos meses.
Los Indicadores Premium de Estrategias de Inversión sitúan al valor en fase alcista, al otorgarle 9 puntos de los 10 posibles, tal y como puede verse en el gráfico.

STA Trust Ha Abonado y Subscrito ya las 444.400 Nuevas Acciones de PharmaMar, Que Representan un 0,2 % de su Capital Social, a un Precio de 4,75 euros por Título . PharmaMar Recibirá un Abono Inicial por la Firma del Contrato, Pagos Recurrentes Por Ventas y Remuneraciones Adicionales Por los Hitos Regulatorios Que Se Vayan Alcanzando .
Suscribirse a:
Comentarios (Atom)

















