PHARMAMAR . EL FONDO CORTO SHAW. D.E. & Co COMUNICA A LA CNMV QUE VUELVE A AMPLIAR SU APUESTA BAJISTA HASTA LOS 8,5 MILLONES DE €UROS . YA TIENE UNA POSICIÓN DEL 0,6% CON 108.000 ACCIONES DE LA COMPAÑÍA . LOS FONDOS CORTOS ENTRAN EN UN VALOR ... VENDIENDO SIEMPRE AL ALZA LAS ACCIONES QUE ALGUIEN LE PRESTA ...
31 mayo 2011
Desde Pharmamar han avanzado que compañías no Europeas se han interesado por sus Canales de Venta.
El cáncer y el Alzheimer copan las inversiones en I+D .
Los fármacos oncológicos y neurodegenerativos acaparan la mayor parte de los 500 millones que las biotecnológicas invierten cada año en España.
...
...
30 mayo 2011
Salamanca . Investigadores hallan un fármaco contra el cáncer de mama más peligroso .
*.- El descubrimiento revolucionará el tratamiento de este tumor
*.- No había habido avances desde hace 30 años
*.- Hasta el momento sólo se aborda con quimioterapia
...
*.- No había habido avances desde hace 30 años
*.- Hasta el momento sólo se aborda con quimioterapia
...
28 mayo 2011
27 mayo 2011
26 mayo 2011
25 mayo 2011
La carne roja eleva el riesgo de sufrir cancer de colon .
El cáncer colorectal es el tercero más común diagnosticado en el país, excluyendo los distintos tipos de cáncer de piel, de acuerdo a la American Cancer Society
La investigación, realizada por el American Institute for Cancer Research y el Cancer Research Fund, aporta evidencia sólida en contra de la carne roja, pues esta podría contribuir a la aparición del cáncer de colón.
Cuando se sigue el consejo de disminuir el consumo de carne roja o procesada, y se lo combina con ejercicio, ingesta de fibras y disminución del alcohol, el cáncer de colon se puede prevenir hasta en un 45%, lo que en cifras significa 64 mil casos de este cáncer al año.
...
La investigación, realizada por el American Institute for Cancer Research y el Cancer Research Fund, aporta evidencia sólida en contra de la carne roja, pues esta podría contribuir a la aparición del cáncer de colón.
Cuando se sigue el consejo de disminuir el consumo de carne roja o procesada, y se lo combina con ejercicio, ingesta de fibras y disminución del alcohol, el cáncer de colon se puede prevenir hasta en un 45%, lo que en cifras significa 64 mil casos de este cáncer al año.
...
New York : “Nuevas Fronteras en el Descubrimiento de Fármacos Marinos . Desarrollo de Nuevas Terapias a partir de Productos Naturales del Mar”.

Primer Foro de Biotecnología Marina aplicada a la Salud organizado por la Academia de Ciencias de Nueva York .
Más de 100 Personalidades debaten sobre la Biotecnología Marina aplicada a la Salud .
 El Grupo Zeltia ha participado en el primer foro de biotecnología marina aplicada a la salud organizado por la Academia de Ciencias de Nueva York (NYAS). La jornada se celebró el pasado viernes 20 de mayo en la sede de NYAS, en Nueva York, bajo el título de “Nuevas fronteras en el descubrimiento de fármacos marinos: Desarrollo de nuevas terapias a partir de productos naturales del mar”.
El Grupo Zeltia ha participado en el primer foro de biotecnología marina aplicada a la salud organizado por la Academia de Ciencias de Nueva York (NYAS). La jornada se celebró el pasado viernes 20 de mayo en la sede de NYAS, en Nueva York, bajo el título de “Nuevas fronteras en el descubrimiento de fármacos marinos: Desarrollo de nuevas terapias a partir de productos naturales del mar”.El evento, concebido como un foro de discusión de referencia sobre las últimas novedades y avances en el campo de la biotecnología marina aplicada a la salud, reunió a más de 100 personalidades del mundo científico, académico y empresarial.
Willian Fenical, del Centro de Biotecnología y Biomedicina Marina del Instituto Scripps de Oceanografía, en la Universidad de San Diego; Shirley Pomponi, del Instituto Oceanográfico Harbor Branch, en Florida Atlantic University; Juli M. Trtanj, de NOAA National Ocean Service; Marta Murcia, de NYAS, y Roberto Weinmann, CCO de PharmaMar USA, formaron el comité científico del evento. Yves Pommier, del National Cancer Institute (NIH); Shirley Pomponi y Roberto Weinmann presidieron las sesiones.
El doctor Arturo Soto Matos-Pita, director de desarrollo clínico de PharmaMar (Grupo Zeltia), participó en el foro exponiendo la labor de investigación de PharmaMar en el campo de la biotecnología marina, donde la compañía consta con más de 25 años de experiencia. En ella expuso cómo es el desarrollo clínico de un antitumoral de origen marino y los principales retos que plantea un producto de esta naturaleza hasta conseguir su aprobación por las autoridades reguladoras.
24 mayo 2011
Fumadores tienen poca posibilidad de sobrevivir a cáncer colon .
Los fumadores no serían más propensos sólo a desarrollar cáncer de colon que los no fumadores, sino también a morir por la enfermedad.
Un nuevo estudio, publicado en la revista Cancer, demuestra que tenían un 30 por ciento más riesgo de morir por cáncer de colon durante el estudio y un 50 por ciento más posibilidad de morir por cualquier causa que los participantes que no fumaban.
Los ex fumadores también tenían menos posibilidad de sobrevivir a la enfermedad que los no fumadores, pero una mejor perspectiva que los fumadores.
"Si alguien necesita un motivo para no fumar, o dejar de hacerlo, este es mejor que cualquiera", dijo la autora principal, Amanda Phipps, del Centro de Investigación del Cáncer Fred Hutchinson, en Seattle.
...
Un nuevo estudio, publicado en la revista Cancer, demuestra que tenían un 30 por ciento más riesgo de morir por cáncer de colon durante el estudio y un 50 por ciento más posibilidad de morir por cualquier causa que los participantes que no fumaban.
Los ex fumadores también tenían menos posibilidad de sobrevivir a la enfermedad que los no fumadores, pero una mejor perspectiva que los fumadores.
"Si alguien necesita un motivo para no fumar, o dejar de hacerlo, este es mejor que cualquiera", dijo la autora principal, Amanda Phipps, del Centro de Investigación del Cáncer Fred Hutchinson, en Seattle.
...
Dos estudios del ICO relacionan el cáncer con el consumo de alcohol .
El primer trabajo, coordinador por el investigador Eric Duell, demuestra que los grandes bebedores de cerveza (3 o más cervezas al día) que poseen una determinada variante genética tienen más riesgo de desarrollar un cáncer gástrico que el resto.
El segundo estudio, encabezado por el investigador del ICO Antoni Agudo y que se ha publicado en la revista "British Medical Journal", indica que el 15 % de los tumores que se diagnostican en España tienen una relación directa con el alcohol.
Según este último estudio, la bebida fue directamente la responsable de 15.671 tumores en 2008, e intervino en casi 5.500 casos más.
Antoni Agudo ha dicho a Efe que "el alcohol está totalmente desaconsejado para prevenir el cáncer, igual que el tabaco, pero al ser beneficioso, con mesura, para otros aspectos, como por ejemplo la salud cardiovascular, hemos de saber donde está el límite".
...
El segundo estudio, encabezado por el investigador del ICO Antoni Agudo y que se ha publicado en la revista "British Medical Journal", indica que el 15 % de los tumores que se diagnostican en España tienen una relación directa con el alcohol.
Según este último estudio, la bebida fue directamente la responsable de 15.671 tumores en 2008, e intervino en casi 5.500 casos más.
Antoni Agudo ha dicho a Efe que "el alcohol está totalmente desaconsejado para prevenir el cáncer, igual que el tabaco, pero al ser beneficioso, con mesura, para otros aspectos, como por ejemplo la salud cardiovascular, hemos de saber donde está el límite".
...
El alzhéimer no comienza por la pérdida de memoria ... Se pueden observar trastornos en el Lenguaje, en la Visión o en la Conducta .
El primer síntoma por el que se acostumbra a detectar la enfermedad de alzhéimer es la falta de memoria. Pero puede no ser el primero, al menos en los casos de aparición precoz (antes de los 60 años). Un equipo de investigadores del hospital Clínic de Barcelona ha detectado la aparición de algunos desórdenes asociados al inicio temprano de esta demencia. Aunque no haya pérdida en la memoria, se pueden observar trastornos en el lenguaje, en la visión o en la conducta. Los resultados los ha publicado la revista Neurology.
...
...
El melanoma aumenta un 10% anual, el único cáncer que sigue extendiéndose .
La incidencia del melanoma aumenta un 10 por ciento cada año, convirtiéndose en el "único" carcinoma que no disminuye su prevalencia. Este tipo de cáncer de piel "tiene características de epidemia", por lo que los dermatólogos alertan de la "necesidad" del diagnóstico precoz, porque "sólo" detectándolo a tiempo es posible su curación.
"Se trata del tumor más maligno que existe aunque también el que tiene las cifras de curación más altas, próximas al 100% si se diagnostica a tiempo", ha subrayado el presidente de la Academia Española de Dermatología y Venereología (AEDV), el doctor José Carlos Moreno, quien ha recordado que se trata de un cáncer cutáneo "muy frecuente, indoloro y muy lento".
...
"Se trata del tumor más maligno que existe aunque también el que tiene las cifras de curación más altas, próximas al 100% si se diagnostica a tiempo", ha subrayado el presidente de la Academia Española de Dermatología y Venereología (AEDV), el doctor José Carlos Moreno, quien ha recordado que se trata de un cáncer cutáneo "muy frecuente, indoloro y muy lento".
...
23 mayo 2011
SYL1001 terminada la Fase Preclinica esta pendiente de iniciar la Fase I para Dolor Ocular . Abstrac presentado en el Congreso ARVO 2011 en Florida .


SYL1001 Targeting TRPV1 Receptor for the Treatment of Ocular Pain associated to Dry Eye Syndrome .
... Results: In vitro and in vivo studies successfully demonstrated that ocular topical administration of SYL1001 was able to reduce TRPV1 levels and ocular pain in New Zealand white rabbits. Moreover, topical administration of SYL1001 prevents ocular pain after pain induction by capsaicin with a similar or higher analgesic effect than the reference analgesic standard. The toxicology experiments performed with SYL1001 by ocular topical route to dogs and rabbits indicated that no side effects were observed during 28-days of treatment. Pharmacokinetic analysis showed that no drug was detected above the detection limit (40 ng/mL) at any time or dose tested.
Conclusions: SYL1001 specifically directed to silence the TRPV1 gene appears to decrease the behavioural response to ocular surface irritation evoked by ocular capsaicin. These channels are involved in the nerve impulse responses to exogenous and endogenous substances mediating inflammation and pain. Toxicology results indicated that SYL1001 did not produce any adverse events related to treatment. SYL1001 has been demonstrated to be safe and efficient in recommended animal models, which suggest this product could be a very good candidate for treatment of ocular pain.
SYL040012 para el tratamiento del glaucoma inicio la Fase I - II en 2010 . Abstract presentado en el Congreso ARVO 2011 en Florida .


SYL040012. Tolerance And Effect On Intraocular Pressure .
... Results:
Local tolerance was excellent. No modifications of the ocular surface or iris were detected. The analytical results at final examination did not show differences from those observed during selection. There were statistical differences between area under curve (AUC) of IOP curves on day four with respect to selection day curve (12% decrease) in all volunteers administered with the low level dose of SYL040012 during seven days. Five of them (with an average basal value of IOP higher than the mean value for the whole group) showed reduction higher than 15%. SYL040012 was not detected in blood.
Conclusions:
The Phase I clinical trial for SYL040012 was completed in 30 healthy volunteers. SYL040012 showed excellent local and systemic tolerance after single and multiple administrations to subjects.
22 mayo 2011
Trabectedina, indicato anche per la recidiva di cancro ovarico .
Una Noticia que Zeltia comunicaba con los resultados del Primer Trimestre 2011 en los que tambien se incluia una mención al Inicio de Fase II del Yondelis , tambien en Italia , en la indicación de Cáncer de Pancreas por parte del Hospital San Rafael de Milan .
Lo que hoy aqui podemos ver ( Picando el titular ) es tal y como lo publico Pharmastar ( Giornale On-line sui Farmaci ...

Lo que hoy aqui podemos ver ( Picando el titular ) es tal y como lo publico Pharmastar ( Giornale On-line sui Farmaci ...

CEK: apuesta por la investigación contra cáncer y alzhéimer .
En la búsqueda de tratamientos para cáncer hepático, alzhéimer o dolencias autoinmunes, el Centro Esther Koplowitz (CEK) de Barcelona interactúa con hospitales públicos, centros de investigación o el CSIC. La apuesta en tecnología se plasma en avances en diagnóstico por imagen y en proyectos para discapacitados, como la visión táctil para invidentes
...
...
20 mayo 2011
Diagnostican cáncer de páncreas a través de una nueva prueba no invasiva .
Científicos de la Clínica Mayo han anunciado la aplicación de una nueva prueba no invasiva para la detección del cáncer de páncreas, que consiste en comprobar si era posible detectar la presencia de metilaciones --un tipo de modificación del ADN estrechamente vinculada al cáncer y pre-cáncer-- en una muestra de heces.
"A través del cáncer de colon se sabe que es posible detectar algunas firmas moleculares de cáncer y pre-cáncer; por ello, nos interesaba hacer el intento de determinar si se podía hacer lo mismo con el cáncer de páncreas, específicamente con una muestra de heces", ha explicado el doctor John Kisiel, gastroenterólogo de la Clínica Mayo que presentó los resultados del estudio.
...
"A través del cáncer de colon se sabe que es posible detectar algunas firmas moleculares de cáncer y pre-cáncer; por ello, nos interesaba hacer el intento de determinar si se podía hacer lo mismo con el cáncer de páncreas, específicamente con una muestra de heces", ha explicado el doctor John Kisiel, gastroenterólogo de la Clínica Mayo que presentó los resultados del estudio.
...
.Una familia colombiana podría ser la clave para curar el Alzheimer .
Una familia en Colombia —que padece Alzheimer temprano y hereditario— participa en una prueba con nuevos fármacos que los médicos esperan puedan llevar a una cura para los enfermos de todo el mundo.
...
...
Barbacid: «El cáncer nunca se podrá erradicar, pero será controlado» .
 Nunca se podrá erradicar el cáncer, pero sí se podrá controlarlo. La sociedad debe aceptar que se trata de un conjunto de más de cien enfermedades que son intrínsecas al ser humano y que se debe a la pérdida de funciones de nuestras células por el paso del tiempo». Lo explicó ayer el profesor Mariano Barbacid, uno de los referentes mundiales en la investigación contra el cáncer, en su investidura como Doctor Honoris Causa por la Universidad de Cantabria .
Nunca se podrá erradicar el cáncer, pero sí se podrá controlarlo. La sociedad debe aceptar que se trata de un conjunto de más de cien enfermedades que son intrínsecas al ser humano y que se debe a la pérdida de funciones de nuestras células por el paso del tiempo». Lo explicó ayer el profesor Mariano Barbacid, uno de los referentes mundiales en la investigación contra el cáncer, en su investidura como Doctor Honoris Causa por la Universidad de Cantabria ....
19 mayo 2011
Rosario Cospedal. Entrevista a la Directora de Genómica (Zeltia):Si un país apuesta por el diagnóstico precoz y preciso,gastara menos en Tratamientos.
 P.- ¿Cómo y cuándo nace Genómica?
P.- ¿Cómo y cuándo nace Genómica?R.- Nace en 1990 para dar respuesta a la necesidad de emplear la tecnología del ADN para la identificación de individuos. La compañía empieza a trabajar con los cuerpos de seguridad del estado, montando los laboratorios de la Policía y la Guardia Civil. Poco después, ofrece servicios de identificación genética en el ámbito privado, siendo pionera en pruebas de paternidad, parentesco y huella genética.
También ofrece proyectos llave en mano a otros países que todavía no tienen laboratorios de criminalística (Marruecos, Panamá, El Salvador y Venezuela). Dos o tres años después se decide a entrar en el campo del diagnóstico molecular, utilizando también la tecnología del ADN, y empieza a diseñar kits de diagnóstico. El primer producto es el kit del virus del papiloma humano (VPH). La empresa empieza a centrarse en el mundo de las enfermedades infecciosas: herpes humanos, hepatitis, tuberculosis, etc., y obtiene bastante éxito.
Supone un cambio radical en la tecnología empleada por los médicos hasta entonces, y permite hacer un diagnóstico rápido y precoz.
P.- Una tecnología que, sin embargo, ha seguido avanzando.
R.- Efectivamente. En el año 2003 Genómica decide dar un salto y desarrolla la tecnología CLART (Clinical Array Technology), una marca propia que comercializamos en el año 2005. El primer producto que se lanza es también el del VPH, que tiene un éxito rotundo, ya que es una tecnología muy específica, muy sensible, muy robusta y muy fiable que permite hacer un diagnóstico muy precoz y automatizado.
P.- ¿Qué proyectos tiene Genómica en estos momentos?
R.- Queremos entrar en nuevos campos. Esperamos lanzar nuestro primer kit oncológico durante el primer trimestre del año que viene y, seguramente, también podremos entrar en el campo de la detección de proteínas, la inmunología, etc.
P.- ¿Qué distingue a la compañía de la competencia?
R.- La calidad. Somos una empresa relativamente pequeña que compite con las grandes multinacionales del diagnóstico. Nuestros productos deben ser 100% fiables, muy robustos y estar desarrollados con las máximas garantías de calidad. Disponemos de las acreditaciones y certificaciones propias de nuestra actividad: ISO 9001, ISO 13485, somos la primera empresa acreditada en identificación genética en España, etc.
P.- ¿Quiénes son los clientes de los kits de diagnóstico?
R.- Podríamos decir que el 90% de nuestros clientes españoles son laboratorios hospitalarios del Sistema Nacional de Salud, pero alrededor del 30% de nuestras ventas proviene de la exportación. Fuera de España, nuestros clientes también suelen ser los hospitales, aunque en algunos países hay más medicina privada y, por tanto, nuestra clientela se compone más bien de grandes laboratorios privados.
...
Instituto de Investigación Biomédica de Bellvitge (Idibell) . Investigadores catalanes identifican un nuevo gen asociado al cáncer de mama .
 Un estudio internacional liderado por investigadores del Instituto de Investigación Biomédica de Bellvitge (Idibell) ha identificado un nuevo gen implicado en la susceptibilidad de sufrir cáncer de mama.
Un estudio internacional liderado por investigadores del Instituto de Investigación Biomédica de Bellvitge (Idibell) ha identificado un nuevo gen implicado en la susceptibilidad de sufrir cáncer de mama.El estudio, publicado en la revista 'Breast Cancer Research and Treatment', ha analizado variantes genéticas del gen TNFRSF11A que codifica la proteína RANK y desempeña un papel fundamental en el proceso de desarrollo y diferenciación de las células del epitelio de la mama y en la iniciación de los tumores de mama.
...
Descubren la clave para luchar contra la leucemia resistente a fármacos . La clave está en BCL6 .
La clave está en BCL6, la proteína que utilizan las células de leucemia para mantenerse vivas. Dirigirse contra esta proteína podría ser la clave para combatir la leucemia resistente a fármacos, un descubrimiento que podría aumentar la eficacia de los fármacos contra el cáncer y ayudar a los médicos a recetar combinaciones de medicamentos más poderosas que curen a más niños con leucemia.
Para el autor principal de este estudio, Markus Müschen, profesor del laboratorio de Medicina de la UCSF, "creemos que este hallazgo es de importancia inmediata para el cuidado de los pacientes".
...
Para el autor principal de este estudio, Markus Müschen, profesor del laboratorio de Medicina de la UCSF, "creemos que este hallazgo es de importancia inmediata para el cuidado de los pacientes".
...
Tomar café puede reducir el riesgo de padecer el cáncer de próstata .
 Investigadores de la Escuela de Salud Pública de la Universidad de Harvard, en Estados Unidos, aseguran que los hombres que toman café pueden tener menos riesgo de desarrollar la variante más agresiva y mortal del cáncer de próstata.
Investigadores de la Escuela de Salud Pública de la Universidad de Harvard, en Estados Unidos, aseguran que los hombres que toman café pueden tener menos riesgo de desarrollar la variante más agresiva y mortal del cáncer de próstata.Además, y según los resultados del estudio que publica el 'Journal of the National Cancer Institute', esta disminución se consigue tanto en aquellos que consumen café normal como en los que optan por el descafeinado.
...
18 mayo 2011
17 mayo 2011
Societe Generale identifies the following European companies as top takeover targets : Zeltia (ZEL.MC), Heidelberger Druck (HDDG.DE), Sevan Marine ...
 Reuters UK . Tue May 17, 2011 9:40am BST
Reuters UK . Tue May 17, 2011 9:40am BST Equities will benefit from the strong cash positions on corporate balance sheets, which will fuel more activity in mergers and acquisitions, says Societe Generale.
... Societe Generale identifies five sectors that stand out as having high potential: building materials, office/business equipment, iron/steel, home builders and biotechnology.
It identifies the following European companies as top takeover targets: Zeltia (ZEL.MC), Heidelberger Druck (HDDG.DE), Sevan Marine (SEVAN.OL), Elan (ELN.I), Sonae Industria (SONI.LS), Tiscali (TIS.MI), BTG (BGC.L), Norske Skogindustrier (NSG.OL), Renewable Energy (REC.OL), and Bobst Group (BOBNN.S).
Crizotinib Fármaco Pfizer para cáncer pulmonar obtendrá revisión rápida FDA .
P.D.: Es bueno leer y saber sobre este tipo de revisiones prioritarias ya que hay un Farmaco del Grupo Zeltia que tambien la tiene concedida ( Paralisis Supranuclear Progresiva ) .
************************************************
Un medicamento experimental de Pfizer Inc contra el cáncer pulmonar recibirá revisión rápida de los reguladores de salud de Estados Unidos, según informó el martes el laboratorio.
El fármaco, denominado crizotinib, es uno de los más importantes en etapa final de experimentación con los que cuenta Pfizer Inc, el mayor laboratorio del mundo, que cada vez está incursionando más en el área oncológica.
Pfizer está buscando aprobación de crizotinib para el tratamiento de pacientes con cierta forma avanzada de cáncer de pulmón de células no pequeñas.
Al garantizar una revisión prioritaria, la Administración de Alimentos y Medicamentos de Estados Unidos (FDA por su sigla en inglés) acelerará los tiempos de revisión a seis meses, a diferencia de los 10 a 12 meses que suele demorar el proceso.
Este tipo de revisiones aceleradas se brindan a los productos que se consideran avances terapéuticos potencialmente importantes respecto de las terapias existentes.
...
************************************************
Un medicamento experimental de Pfizer Inc contra el cáncer pulmonar recibirá revisión rápida de los reguladores de salud de Estados Unidos, según informó el martes el laboratorio.
El fármaco, denominado crizotinib, es uno de los más importantes en etapa final de experimentación con los que cuenta Pfizer Inc, el mayor laboratorio del mundo, que cada vez está incursionando más en el área oncológica.
Pfizer está buscando aprobación de crizotinib para el tratamiento de pacientes con cierta forma avanzada de cáncer de pulmón de células no pequeñas.
Al garantizar una revisión prioritaria, la Administración de Alimentos y Medicamentos de Estados Unidos (FDA por su sigla en inglés) acelerará los tiempos de revisión a seis meses, a diferencia de los 10 a 12 meses que suele demorar el proceso.
Este tipo de revisiones aceleradas se brindan a los productos que se consideran avances terapéuticos potencialmente importantes respecto de las terapias existentes.
...
Las Aguas del Olvido .
Dicen en algunas tribus de África que cuando se muere un anciano es como si se incendiase una biblioteca, porque con él se va la memoria de muchas historias vividas y compartidas.
¿Y qué ocurre cuando una persona contrae la enfermedad de Alzheimer, y sus vivencias se borran, y sus recuerdos saltan por los aires, y su experiencia se apaga como una vela mortecina frente a los manotazos del viento? Se calcula que, desde ahora mismo hasta el año 2050, unos cien millones de personas podrían perder sus recuerdos, su memoria, la conciencia y la consciencia de sí mismos, afectados por ese mal, por el Alzheimer, que también es un incendio en el archivo mental en que se guarda el pasado.
...
¿Y qué ocurre cuando una persona contrae la enfermedad de Alzheimer, y sus vivencias se borran, y sus recuerdos saltan por los aires, y su experiencia se apaga como una vela mortecina frente a los manotazos del viento? Se calcula que, desde ahora mismo hasta el año 2050, unos cien millones de personas podrían perder sus recuerdos, su memoria, la conciencia y la consciencia de sí mismos, afectados por ese mal, por el Alzheimer, que también es un incendio en el archivo mental en que se guarda el pasado.
...
16 mayo 2011
14 mayo 2011
Symposium en New York: New Frontiers in Marine Drug Discovery: Developing New Therapies From Marine Natural Products. Organizado por Zeltia el 20 May.
13 mayo 2011
Samantha se ríe del cáncer .
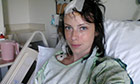 Hasta un tumor cerebral puede tener su gracia, si uno se empeña en mirar el lado positivo de la vida. En esa lucha entre la cruda realidad y el humor se encuentra Samantha Kittle, una neoyorquina de 26 años diagnosticada hace unos meses y cuyo blog ('A lie of the mind') se está convirtiendo en un referente para muchos pacientes con su mismo diagnóstico.
Hasta un tumor cerebral puede tener su gracia, si uno se empeña en mirar el lado positivo de la vida. En esa lucha entre la cruda realidad y el humor se encuentra Samantha Kittle, una neoyorquina de 26 años diagnosticada hace unos meses y cuyo blog ('A lie of the mind') se está convirtiendo en un referente para muchos pacientes con su mismo diagnóstico....
Takeda , la mayor Farmaceutica Asiatica , ofrece 12.330 millones por la suiza Nycomed .
Deutsche Bank es el banco que está asesorando a Takeda en esta adquisición, que está en una etapa avanzada. Según fuentes cercanas a la operación, la compra podría cerrarse como muy pronto la próxima semana.
La nipona Takeda ofrece 12.330 millones de dólares por su principal competidora suiza, aunque otras fuentes próximas a la operación hablan de una oferta que ronda los 8.000 millones de dólares. De hecho, Nycomed podría estar esperando un montante de más de 10.000 millones de euros, según apunta otra tercera fuente que cita Bloomberg.
...
La nipona Takeda ofrece 12.330 millones de dólares por su principal competidora suiza, aunque otras fuentes próximas a la operación hablan de una oferta que ronda los 8.000 millones de dólares. De hecho, Nycomed podría estar esperando un montante de más de 10.000 millones de euros, según apunta otra tercera fuente que cita Bloomberg.
...
El neurocientífico y catedrático de la Universidad Autónoma de Barcelona (UAB) Ignacio Morgado ha explicado que la estimulación eléctrica será el ...
... tratamiento "más efectivo" para las enfermedades mentales.
...
...
12 mayo 2011
La FDA autoriza 'Afinitor' (Novartis) para tratar tumores neuroendocrinos avanzados de origen pancreático .
La Agencia Estadounidense del Medicamento (FDA, por sus siglas en inglés) ha autorizado 'Afinitor' (everolimus), de los laboratorios Novartis, para el tratamiento de tumores neuroendrocrinos de origen pancreático (PNET, por sus siglas en inglés) en pacientes metastásicos, inoperables o con tumores localmente avanzados. Esta decisión, anunciada el pasado 5 de mayo, supone la primera autorización de una terapia en casi 30 años para estos pacientes en Estados Unidos.
...
...
Consiguen controlar la infección por el virus del sida con un nuevo método de vacunación .
Investigadores de la Universidad de Ciencias de la Salud de Oregon en Beaverton (Estados Unidos) han conseguido el control eficaz de la infección en un modelo animal de VIH, concretamente en monos, utilizando un nuevo método de vacunación de administración viral a la célula. Los resultados del trabajo se publican en la revista 'Nature'.
...
...
11 mayo 2011
El consumo de café reduce el riesgo de un tipo de cáncer de mama .
Las personas que toman café tienen menor riesgo de padecer cáncer de mama negativo al receptor de estrógeno resistente a los antiestrógenos, aunque se desconocen los mecanismos implicados en esta asociación, según un estudio del Instituto Karolinska en Estocolmo (Suecia), que se publica en la revista 'Breast Cancer Research'.
...
...
10 mayo 2011
Zeltia inicia la venta de Yondelis contra el cáncer de ovario en Italia ... en Francia esta previsto conseguir vender Yondelis Ova antes del 30 de Jun
Añadir que tambien se ha conseguido la aprobación del Yondelis Ova en Chile por parte de J&J y que Yondelis OVA aun estando aprobado en Europa son pocos los ingresos que genera aún en Ovario dado que paises como Italia , Francia les ha costado el dar su OK al reembolso ... y paises como España tarda una media de 400 dias en pagar ...
Zeltia ha comenzado en abril la comercialización de Yondelis para el tratamiento de cáncer de ovario en Italia. Este país es de vital importancia para los planes de futuro de Zeltia. Se trata de uno de los cinco grandes mercados farmacéuticos de la Unión Europea.
La compañía biotecnológica que preside José María Fernández Sousa ya opera en dos de las grandes plazas europeas: Alemania y España.
Pharmamar, la filial de Zeltia que produce y vende el medicamento, prevé iniciar la comercialización en Francia contra cáncer de ovario en el primer semestre de este ejercicio .
...
Este ejercicio ha comenzado con el objetivo de alcanzar el equilibrio en Ebitda (beneficio antes de intereses, impuestos, depreciaciones y amortizaciones). Precisamente, el Ebitda en el primer trimestre se situó en negativo. "Hemos iniciado en este primer trimestre ensayos clínicos en alzheimer, con Sylentis y otros estudios en oncología que han aumentado los gastos en I+D. Esto no afecta al objetivo de break even de beneficio operativo en 2011", explicó José Luis Moreno, director de Mercado de Capitales de Zeltia. El incremento del gasto en I+D del 20% provocó que las pérdidas del grupo crecieran un 58%. Las ventas de todo el grupo ascendieron en este periodo un 7,5%.
Zeltia ha comenzado en abril la comercialización de Yondelis para el tratamiento de cáncer de ovario en Italia. Este país es de vital importancia para los planes de futuro de Zeltia. Se trata de uno de los cinco grandes mercados farmacéuticos de la Unión Europea.
La compañía biotecnológica que preside José María Fernández Sousa ya opera en dos de las grandes plazas europeas: Alemania y España.
Pharmamar, la filial de Zeltia que produce y vende el medicamento, prevé iniciar la comercialización en Francia contra cáncer de ovario en el primer semestre de este ejercicio .
...
Este ejercicio ha comenzado con el objetivo de alcanzar el equilibrio en Ebitda (beneficio antes de intereses, impuestos, depreciaciones y amortizaciones). Precisamente, el Ebitda en el primer trimestre se situó en negativo. "Hemos iniciado en este primer trimestre ensayos clínicos en alzheimer, con Sylentis y otros estudios en oncología que han aumentado los gastos en I+D. Esto no afecta al objetivo de break even de beneficio operativo en 2011", explicó José Luis Moreno, director de Mercado de Capitales de Zeltia. El incremento del gasto en I+D del 20% provocó que las pérdidas del grupo crecieran un 58%. Las ventas de todo el grupo ascendieron en este periodo un 7,5%.
Nypta inicia la Fase IIb en 40 Centros repartidos en 6 Paises para evaluar Eficacia, Seguridad y Tolerabilidad en 280 Pacientes con Alzheimer .
 Nypta® (tideglusib) para enfermedad de Alzheimer (EA).
Nypta® (tideglusib) para enfermedad de Alzheimer (EA).*.- En 2010 concluyó el primer ensayo clínico de Fase IIa con Nypta® (tideglusib) en pacientes con Enfermedad de Alzheimer ( E.A.) en Alemania. Se trató de un estudio aleatorio, doble-ciego, controlado por placebo en el que 30 pacientes con E.A. fueron tratados con dosis escaladas de Nypta® (tideglusib) administrado por vía oral durante 20 semanas. El objetivo primario de este estudio era determinar la seguridad y la tolerabilidad del compuesto en pacientes con E.A.
*.- De forma adicional, se estudiaron ciertas medidas cognitivas y diferentes biomarcadores.
*.- Los resultados completos de seguridad y eficacia de este ensayo de Fase IIa fueron presentados en el ICAD (International Conference on Alzheimer’s Disease) en Hawai en Julio de 2010. Nypta® (tideglusib) fue bien tolerado y ha mostrado efectos positivos en cuatro de las 5 variables de eficacia examinadas en este ensayo.
*.- Noscira pretende confirmar estos prometedores resultados en este recien iniciado estudio de Fase IIb de Prueba de Eficacia con Nypta® (tideglusib), denominado ARGO (Alzheimer’s Research in GSK-MOdulation)cuyos datos podrían estar entre Julio y Octubre del 2012 .
 *.- Se trata de un estudio aleatorio, doble-ciego, controlado por placebo para determinar la eficacia y seguridad del compuesto en 280 pacientes con E.A. que serán tratados con dos dosis y dos regímenes diferentes durante 6 meses más un período de extensión de hasta 15 meses en Europa. El objetivo primario del estudio es evaluar los cambios cognitivos en pacientes con EA leve-moderada tras la administración de Nypta® (tideglusib) frente a placebo. La evaluación de la seguridad y tolerabilidad de Nypta® (tideglusib) es el principal objetivo secundario del estudio.
*.- Se trata de un estudio aleatorio, doble-ciego, controlado por placebo para determinar la eficacia y seguridad del compuesto en 280 pacientes con E.A. que serán tratados con dos dosis y dos regímenes diferentes durante 6 meses más un período de extensión de hasta 15 meses en Europa. El objetivo primario del estudio es evaluar los cambios cognitivos en pacientes con EA leve-moderada tras la administración de Nypta® (tideglusib) frente a placebo. La evaluación de la seguridad y tolerabilidad de Nypta® (tideglusib) es el principal objetivo secundario del estudio.*.- La intención es de trabajar en consenso con las agencias reguladoras se solicitó ante la Agencia Europea del Medicamento (EMA, de sus actuales siglas en inglés) la continuidad de asesoramiento científico (scientific advice - follow up), ya iniciado con el estudio de Fase IIa. Noscira discutió sus aproximaciones en dicho organismo con sede en Londres en el mes de Marzo.
*.- Se ha trabajado conjuntamente con la CRO (empresa que investiga por contrato) elegida en la preparación de toda la documentación necesaria y requerida así como en la selección de aproximadamente 40 centros que participarán en el estudio y que están repartidos en 6 países (España, Alemania, Reino Unido, Francia, Bélgica y Finlandia). A Finales del 2010 el estudio ya se había presentado a las autoridades reguladoras de España, Francia, Reino Unido y Bélgica, habiéndose conseguido la aprobación de la agencia inglesa antes del cierre del mismo.
**********************************************
Datos de Ensayo :
Efficacy, Safety and Tolerability of Tideglusib to Treat Mild-to-Moderate Alzheimer's Disease Patients (ARGO).
This study is currently recruiting participants.
Verified on May 2011 by Noscira SA .
First Received on May 6, 2011.
Sponsor: Noscira SA
Collaborator: ICON Clinical Research
Information provided by: Noscira SA
ClinicalTrials.gov Identifier: NCT01350362
Estimated Enrollment: 280
Study Start Date: April 2011
Estimated Study Completion Date: October 2012
Estimated Primary Completion Date: July 2012 (Final data collection date for primary outcome measure)
09 mayo 2011
El departamemnto de análisis de Renta 4 recomienda tomar posiciones en Zeltia si los títulos del valor cierran por encima de los 3,2 euros .
ZELTIA pierde la directriz alcista que guiaba las alzas desde finales de 2010, según señalan desde Renta 4 y lo hace con un gap bajista en 2,8 € "que hará de resistencia en los rebotes." A medio plazo "será necesaria una superación de la franja de 3,2€ (soporte durante 2010 y que ahora representa obstáculo a las alzas) para hablar de un cambio de tendencia."
Safety Profile of Yondelis in Combination With Liposomal Pegylated Doxorrubicin in Relapsed Ovarian Carcinoma: Considerations for Optimal Management .
International Journal of Gynecological Cancer .May 2011 - Volume 21 - Issue 10 - pp S6-S8 .
Martín, Antonio González MD . Medical Oncology Department, Cancer Center M.D. Anderson International, Madrid, Spain .
Abstract :
The toxicity profile of trabectedin in the OVA-301 trial, that combined trabectedin with pegylated liposomal doxorubicin for the treatment of patients with ovarian cancer, has shown to be predictable and manageable. No unexpected toxicities were found, with neutropenia and transient increase in transaminases as the most common adverse events reported. The elevation in transaminases appeared early and generally decreased in incidence and intensity over subsequent cycles, with no major clinical consequences. A similar safety profile was seen in the analysis of the older patients in the trial. There were no detrimental effects in quality of life with the combination. Moreover, the Global Health Status score was better for the combination arm in those patients with a PFI of 6 to 12 months that were in response after 5 cycles. Trabectedin with pegylated liposomal doxorubicin is not associated with cumulative end-organ toxicities (renal, cardiac, or neurological toxicities). The toxicity profile is different from other second-line strategies without the presence of inconvenient side effects, such as alopecia, hypersensitivity reactions, hand-foot syndrome, or mucositis.
Copyright © 2011 by IGCS and ESGO
Martín, Antonio González MD . Medical Oncology Department, Cancer Center M.D. Anderson International, Madrid, Spain .
Abstract :
The toxicity profile of trabectedin in the OVA-301 trial, that combined trabectedin with pegylated liposomal doxorubicin for the treatment of patients with ovarian cancer, has shown to be predictable and manageable. No unexpected toxicities were found, with neutropenia and transient increase in transaminases as the most common adverse events reported. The elevation in transaminases appeared early and generally decreased in incidence and intensity over subsequent cycles, with no major clinical consequences. A similar safety profile was seen in the analysis of the older patients in the trial. There were no detrimental effects in quality of life with the combination. Moreover, the Global Health Status score was better for the combination arm in those patients with a PFI of 6 to 12 months that were in response after 5 cycles. Trabectedin with pegylated liposomal doxorubicin is not associated with cumulative end-organ toxicities (renal, cardiac, or neurological toxicities). The toxicity profile is different from other second-line strategies without the presence of inconvenient side effects, such as alopecia, hypersensitivity reactions, hand-foot syndrome, or mucositis.
Copyright © 2011 by IGCS and ESGO
07 mayo 2011
06 mayo 2011
Los oncólogos médicos piden "no generar falsas expectativas" con la divulgación de investigaciones en cáncer .
La Sociedad Española de Oncología Médica (SEOM) hace un llamamiento tanto a los investigadores como a los medios de comunicación para que sean más "rigurosos" a la hora de divulgar los resultados de una investigación científica ya que se "generan falsas expectativas" en los pacientes, que viven "con angustia" cualquier avance.
Según reconoce el presidente de esta sociedad científica, el doctor Emilio Alba, la información sobre temas relacionados con la salud ocupan cada vez más espacio en los medios de comunicación, que "a diario tienen noticias sobre avances científicos que luego tardan mucho en llegar a la práctica clínica".
...
Según reconoce el presidente de esta sociedad científica, el doctor Emilio Alba, la información sobre temas relacionados con la salud ocupan cada vez más espacio en los medios de comunicación, que "a diario tienen noticias sobre avances científicos que luego tardan mucho en llegar a la práctica clínica".
...
Garmendia suspende con el cáncer .
El laboratorio de Mariano Barbacid, del Centro Nacional de Investigaciones Oncológicas (CNIO) en Madrid, ha identificado en ratones una diana (c-Raf) óptima para dirigir contra ella nuevos fármacos contra el cáncer de pulmón. El desarrollo de esas moléculas, sin embargo, se ve frenado por discrepancias con el Ministerio de Ciencia e Innovación, que juzga "ilegal" la fórmula elegida para captar 10 millones de financiación privada… y lo ha vetado.
...
...
España paga y recupera su voto en un centro de cáncer .
Después de la denuncia presentada por Izquierda Unida en los medios de comunicación, han bastado unas horas para que el Gobierno corrija un error burocrático que databa del año 2009. Así, después de poner al día sus deudas, nuestro país ha recuperado su voto en las reuniones de la Agencia Internacional del Cáncer (IARC), dependiente de la Organización Mundial de la Salud.
Según han informado fuentes del Ministerio de Ciencia, el Instituto de Salud Carlos III, encargado de la representación institucional y científica de España en este organismo internacional, ya ha realizado una transferencia de 850.000 euros correspondiente a la cuota de 2011, por lo que podrán participar en la toma de decisiones en la próxima reunión, que se celebra el jueves.
...
Según han informado fuentes del Ministerio de Ciencia, el Instituto de Salud Carlos III, encargado de la representación institucional y científica de España en este organismo internacional, ya ha realizado una transferencia de 850.000 euros correspondiente a la cuota de 2011, por lo que podrán participar en la toma de decisiones en la próxima reunión, que se celebra el jueves.
...
Los pacientes con tumores raros disponen hoy de nuevos tratamientos más eficaces y manejables .
El conocimiento de la biología molecular implicada en la formación y el desarrollo de los tumores raros es en la actualidad considerablemente mayor al de hace unos años. Así lo han manifestado los expertos en Oncología que han participado en el I Simposio Nacional de Tumores Raros.
Nota de prensa
Imprimir"Mail al comunicadorEnviar por e-mailCompartir
FacebookMeneameDelicioustwitterLos pacientes con tumores raros disponen hoy de nuevos tratamientos más eficaces y manejables
Se celebra en Madrid el I Simposio Nacional de Tumores Raros
WEBER SHANDWICK - 06/05/2011, 12:05h
o Estos tumores presentan una baja incidencia en la población o se localizan en órganos no habituales.
o Actualmente, es mayor el conocimiento sobre los aspectos biológicos que intervienen en el desarrollo inicial y la proliferación de estos carcinomas
o Una nueva generación de medicamentos orientados a dianas moleculares específicas son capaces de inhibir el crecimiento tumoral
...
Nota de prensa
Imprimir"Mail al comunicadorEnviar por e-mailCompartir
FacebookMeneameDelicioustwitterLos pacientes con tumores raros disponen hoy de nuevos tratamientos más eficaces y manejables
Se celebra en Madrid el I Simposio Nacional de Tumores Raros
WEBER SHANDWICK - 06/05/2011, 12:05h
o Estos tumores presentan una baja incidencia en la población o se localizan en órganos no habituales.
o Actualmente, es mayor el conocimiento sobre los aspectos biológicos que intervienen en el desarrollo inicial y la proliferación de estos carcinomas
o Una nueva generación de medicamentos orientados a dianas moleculares específicas son capaces de inhibir el crecimiento tumoral
...
05 mayo 2011
Sousa hoy: Zeltia terminara 2011 con ebitda positivo. Europa representa el 35 % del Mercado Onco. Yondelis EEUU depende de como negocien J&J y FDA .
Fernández Sousa dice que la empresa prevé otros ingresos no presupuestados y se reafirma en que cerrará 2011 con Ebitda positivo .
 El presidente de Zeltia, José María Fernández Sousa-Faro, ha resaltado que el negocio recurrente de la farmacéutica "va bien" y que su actividad en Europa "va a más", por lo que ha insistido en el bajo impacto que tendrá en la multinacional la retirada de la solicitud presentada por Johnson & Johnson para aprobar el uso de Yondelis en Estados Unidos.
El presidente de Zeltia, José María Fernández Sousa-Faro, ha resaltado que el negocio recurrente de la farmacéutica "va bien" y que su actividad en Europa "va a más", por lo que ha insistido en el bajo impacto que tendrá en la multinacional la retirada de la solicitud presentada por Johnson & Johnson para aprobar el uso de Yondelis en Estados Unidos.
"Era un extraordinario para nosotros y no estaba presupuestado; nuestro negocio recurrente va bien, cada vez vendemos más. Tenemos Europa, que es donde vendemos y cada vez más, pese a las dificultades; cada vez vamos a más", ha defendido en declaraciones a los medios antes de participar en una conferencia sobre la historia de la empresa que preside incluida en las 'bio-comidas Bioga', que organiza el Cluster Tecnolóxico Empresarial das Ciencias da Vida (Bioga).
El presidente de la multinacional gallega ha explicado que los ingresos extraordinarios derivados de la autorización de Yondelis en Estados Unidados se habrían percibido "a final de año, en diciembre" y ha indicado que, aunque tenían "mucha ilusión" en el proyecto, saben que se retrasará y sostienen que no afectará a sus resultados, pues el fármaco está licenciado, en ese país, a Johnson & Johnson.
En cualquier caso, ha dicho que Zeltia tiene previstos "otros extraordinarios". "Son fruto de negociaciones con terceros que no dependen de nosotros y no podemos vender la piel del oso antes de haberlo cazado, pero podría haber algún otro extraordinario", ha revelado y ha defendido que la sociedad cerrará el año con un Ebitda (resultado bruto de explotación) positivo.
También se ha reafirmado en que el mercado preferente de Zeltia es Europa. "Es una Europa de 560 millones de habitantes y que es más de un 35% del mercado oncológico mundial", ha destacado.
Negociación con la fda
Respecto a la entrada en Estados Unidos, ha reiterado que depende de las operaciones de Johnson & Johnson y "de lo que ellos negocien con la FDA —autoridad estadounidense con competencias sobre los medicamentos—". "Lo tienen aprobado prácticamente en todo el mundo, en Estados Unidos no. Ahí hay una situación muy rara con la FDA que no acabamos de entender bien, pero que ahora les piden más datos", ha expuesto Fernández Sousa-Faro.
El reglamento, ha insistido, dice que es necesario "presentar estudios, en plural" y la sociedad americana "solo llevaba uno, aunque es muy bueno". "La verdad es que luego la FDA a veces con un sólo estudio lo aprueba". Así, ha considerado que si Johnson & Johnson negocia que sea suficiente haber iniciado otro estudio puede ser un trámite rápido, pero si es necesario que lo tengan terminado puede demorarse "más de dos años".
 El presidente de Zeltia, José María Fernández Sousa-Faro, ha resaltado que el negocio recurrente de la farmacéutica "va bien" y que su actividad en Europa "va a más", por lo que ha insistido en el bajo impacto que tendrá en la multinacional la retirada de la solicitud presentada por Johnson & Johnson para aprobar el uso de Yondelis en Estados Unidos.
El presidente de Zeltia, José María Fernández Sousa-Faro, ha resaltado que el negocio recurrente de la farmacéutica "va bien" y que su actividad en Europa "va a más", por lo que ha insistido en el bajo impacto que tendrá en la multinacional la retirada de la solicitud presentada por Johnson & Johnson para aprobar el uso de Yondelis en Estados Unidos."Era un extraordinario para nosotros y no estaba presupuestado; nuestro negocio recurrente va bien, cada vez vendemos más. Tenemos Europa, que es donde vendemos y cada vez más, pese a las dificultades; cada vez vamos a más", ha defendido en declaraciones a los medios antes de participar en una conferencia sobre la historia de la empresa que preside incluida en las 'bio-comidas Bioga', que organiza el Cluster Tecnolóxico Empresarial das Ciencias da Vida (Bioga).
El presidente de la multinacional gallega ha explicado que los ingresos extraordinarios derivados de la autorización de Yondelis en Estados Unidados se habrían percibido "a final de año, en diciembre" y ha indicado que, aunque tenían "mucha ilusión" en el proyecto, saben que se retrasará y sostienen que no afectará a sus resultados, pues el fármaco está licenciado, en ese país, a Johnson & Johnson.
En cualquier caso, ha dicho que Zeltia tiene previstos "otros extraordinarios". "Son fruto de negociaciones con terceros que no dependen de nosotros y no podemos vender la piel del oso antes de haberlo cazado, pero podría haber algún otro extraordinario", ha revelado y ha defendido que la sociedad cerrará el año con un Ebitda (resultado bruto de explotación) positivo.
También se ha reafirmado en que el mercado preferente de Zeltia es Europa. "Es una Europa de 560 millones de habitantes y que es más de un 35% del mercado oncológico mundial", ha destacado.
Negociación con la fda
Respecto a la entrada en Estados Unidos, ha reiterado que depende de las operaciones de Johnson & Johnson y "de lo que ellos negocien con la FDA —autoridad estadounidense con competencias sobre los medicamentos—". "Lo tienen aprobado prácticamente en todo el mundo, en Estados Unidos no. Ahí hay una situación muy rara con la FDA que no acabamos de entender bien, pero que ahora les piden más datos", ha expuesto Fernández Sousa-Faro.
El reglamento, ha insistido, dice que es necesario "presentar estudios, en plural" y la sociedad americana "solo llevaba uno, aunque es muy bueno". "La verdad es que luego la FDA a veces con un sólo estudio lo aprueba". Así, ha considerado que si Johnson & Johnson negocia que sea suficiente haber iniciado otro estudio puede ser un trámite rápido, pero si es necesario que lo tengan terminado puede demorarse "más de dos años".
04 mayo 2011
Yondelis Pediatrico Mejora la calidad de vida de un Niño de 8 años tras los fracasos con varios Tratamientos y la progresion de su enfermedad .

Publicado en la edicion de Mayo 2011 del Journal : Current Drug Therapy .
Los sarcomas de tejidos blandos refractarios tienen un mal pronóstico y las opciones de tratamiento limitadas requieren el uso de nuevos agentes quimioterapéuticos.
Presentamos el caso de un niño de ocho años con rabdomiosarcoma metastásico no alveolar del antebrazo derecho (Grupo 3, Etapa III).
Tras el fracaso del tratamiento de varios regímenes de quimioterapia y la progresión de su enfermedad, trabectedina se administró a 1,3 mg/m2 por vía intravenosa durante 24 horas en dos ciclos.
La calidad de vida del paciente mejora señaló como por una disminución significativa de la necesidad de opiáceos y la capacidad para tolerar la ingesta oral.
El fármaco fue bien tolerado, con la excepción de neutropenia transitoria.
Aidan Reed, un niño estadounidense de cinco años que fue diagnosticado con leucemia en septiembre del año pasado, aspira a poder pagar el tratamiento
Barbacid paraliza el desarrollo del fármaco contra el cáncer de pulmón .
El laboratorio de Mariano Barbacid, del Centro Nacional de Investigaciones Oncológicas (CNIO) en Madrid, ha identificado en ratones una diana (c-Raf) óptima para dirigir contra ella nuevos fármacos contra el cáncer de pulmón. El desarrollo de esas moléculas, sin embargo, se ve frenado por discrepancias con el Ministerio de Ciencia e Innovación, que juzga "ilegal" la fórmula elegida para captar 10 millones de financiación privada. Publicado el trabajo, el proyecto puede ser abordado por farmacéuticas de fuera de España.
...
...
03 mayo 2011
Yondelis Ovario . La Fda le pide a J&J un Estudio Adicional , J&J debe decidir si presenta Dossier al iniciar dicho Estudio o cuando lo concluya .
 Otra posible solucion sería que Pharma Mar pusiera a disposición de J&J un ensayo de Fase IV que esta realizando ya .
Otra posible solucion sería que Pharma Mar pusiera a disposición de J&J un ensayo de Fase IV que esta realizando ya .Fernández Sousa aclara e insiste en que la retirada ha sido 'voluntaria' y está basada en la recomendación de la propia FDA de presentar un ensayo adicional de Fase III. De momento se desconocen los plazos puesto que Johnson & Johnson tendrá que valorar si presenta el dossier al inicio del estudio o cuando este esté terminado, lo que podría alargar el proceso hasta dos años. Por su parte, Pharma Mar tiene en marcha un estudio en Fase IV que podría servir y que pone a disposición de su 'socio' americano.
P.D.: Lo mejor de todo son los Resultados de Fase III del OVA 301 en cuanto a la OS y que seran presentados por J&J en el Congreso Oncologico ASCO que es el más importante a nivel mundial ... unos resultados que superan a los presentados ante la FDA en el Dossier del 2009 y que demuestran que Yondelis combinado con Doxil supera con creces los resultados del Farmaco Standar en el tratmiento de 2ª linea en Cáncer de Ovario que es el propio Doxil : 0,7 meses alarga la vida Doxil en solitario y Yondelis combinado con Dosil alarga 2,9 meses la vida de las pacientes :
La Solicitud de Nuevo Fármaco para EEUU, que fue presentada en noviembre de 2008, llevaba como bandera el estudio OVA-301, con el que Pharma Mar ha podido aprobar Yondelis en 63 países de dentro y fuera de la Unión Europea. Los datos de este estudio serán objeto de presentación el 5 de junio de 2011 en el Annual Meeting of the American Society of Clinical Oncologists (ASCO) y, aunque Fernández Sousa no ha podido desvelarlos, sí ha adelantado 'que serán mejores que los que ya se conocen, que rondan de media los 2,9 meses de supervivencia frente a los 0,7 meses de Doxil, el fármaco más vendido y utilizado para cáncer de ovario'.
...
Se espera alcanzar contrato de Licencia . La OS del Yondelis Ova es de 2,9 meses superior al infome anterior. De Ampliación de Capital Nada de Nada .
 P.D.: En otra nota de Reuters cabe destacar :
P.D.: En otra nota de Reuters cabe destacar :El presidente de Zeltia se mostró también confiado en que la empresa siguiera siendo capaz de hacer frente a sus necesidades de financiación sin tener que recurrir a una ampliación de capital. "Desde 2009, es un tema recurrente entre algunos analistas, pero nosotros no lo vemos así", dijo Fernández-Sousa.
Actualmente Pharma Mar tiene en marcha un estudio en fase IV con 'Yondelis' en la misma indicación que "podría valer como estudio pivotal" para la aprobación en Estados Unidos.
*********************************
MADRID (Reuters) - El grupo químico-farmacéutico Zeltia dijo el martes que confía en lograr en 2011 un resultado bruto de explotación positivo pese al revés sufrido la semana pasada en el proceso de aprobación de su fármaco Yondelis en EEUU.
"Este tema no debería afectar al negocio recurrente de Zeltia. Nuestro fármaco ya está aprobado en 63 países y las ventas siguen al alza", dijo el presidente de Zeltia José María Fernández-Sousa en una entrevista telefónica con Reuters.
Zeltia anunció el viernes pasado que su socio Johnson & Johnson ha decidido retirar la solicitud para la aprobación de Yondelis en cáncer de ovario en casos recidivantes en EEUU. Tras este anunció, las acciones de Zeltia han bajado más de un seis por ciento entre el lunes y el martes.
La aprobación de Yondelis en EEUU habría sido uno de los catalizadores de creación de valor para Zeltia en 2011, no sólo por el reconocimiento de su fármaco en el principal mercado oncológico del mundo sino también por el pago previsto de 10 millones de dólares por parte de Johnson & Johnson y por los royalties futuros.
Pero el presidente de Zeltia se mostró confiado en poder compensar esta pérdida con posibles ingresos extraordinarios procedentes de contratos de licencias de otros de sus fármacos en desarrollo. "Esto no depende de nosotros, pero tenemos más compuestos en desarrollo con los que intentaremos llegar a algún contrato de licencia", dijo Fernández-Sousa.
"Presentaremos nuevos datos de supervivencia con Yondelis en el congreso oncológico de ASCO en junio. El nuevo análisis, con datos más maduros y con más pacientes mostrará una supervivencia media superior a los 2,9 meses del informe anterior", dijo.
Yondelis, el medicamento más desarrollado de Zeltia, está aprobado en 63 países, la mitad fuera de Europa, pero no todos los sistemas de salud han dado luz verde a su reembolso.
El año pasado, Zeltia tuvo que rebajar sus previsiones de venta por los retrasos en las negociaciones para la obtención de precio de reembolso con algunos países, incluyendo Reino Unido, Francia e Italia, aunque la semana pasada, el grupo dijo que este último país ha dado finalmente luz verde para el reembolso de su fármaco.
Zeltia facturó 35,4 millones de euros en el primer trimestre de 2011, de los cuales más de la mitad los aportó su fármaco oncológico Yondelis.
El presidente de Zeltia se mostró también confiado en que la empresa siguiera siendo capaz de hacer frente a sus necesidades de financiación sin tener que recurrir a una ampliación de capital. "Desde 2009, es un tema recurrente entre algunos analistas, pero nosotros no lo vemos así", dijo Fernández-Sousa.
Según Banco Sabadell, Zeltia tiene que refinanciar unos 30 millones de euros en deuda este año, es decir una tercera parte de su deuda total.
Hasta la fecha la compañía ya ha invertido cerca de 300 millones de euros en la investigación y el desarrollo de novedosos medicamentos antitumorales a base de agentes marinos, aunque, de momento, sólo cuenta con la aprobación de Yondelis para sarcomas y cáncer de ovario en segunda línea.
Zeltia asegura que su negocio no se verá afectado por el retraso en la aprobación de 'Yondelis' en EE.UU : Ebitda positivo en 2011 .
MADRID, 3 May. (EUROPA PRESS) -
El presidente del Grupo Zeltia, José María Fernández Sousa, ha asegurado que el negocio del grupo y, en concreto, de su filial Pharma Mar, no se verán afectados por el retraso de la aprobación del fármaco 'Yondelis' en Estados Unidos, después de que la Agencia Americana del Medicamento (FDA, en sus siglas en inglés) haya pedido un estudio adicional antes de dar luz verde definitiva al uso de este fármaco frente al cáncer de ovario.
Asimismo, tampoco prevé que esta decisión afecte a las ventas de 'Yondelis' en aquellos países donde ya está autorizado, que alcanzaron los 19,6 millones de euros en marzo de 2011 (frente a los 16,6 millones en marzo de 2010).
El pasado viernes, Centocor Ortho Biotech Products, filial del grupo estadounidense Johnson & Johnson, decidió retirar la solicitud de comercialización de 'Yondelis' en Estados Unidos como tratamiento en segunda línea contra el cáncer de ovario en combinación con 'Doxil'.
En las expectativas de Johnson & Johnson y Zeltia estaba que el fármaco pudiese recibir la aprobación definitiva en noviembre de este año, lo que conllevaba además un pago a la biofarmacéutica española de 10 millones de dólares (6,84 millones de euros al cambio actual).
Sin embargo, y pese a que dicho pago se retrasa hasta que se produzca la autorización, Fernández Sousa afirma que "se trata de un pago extraordinario, que no afectará al negocio recurrente de la compañía ya que depende de los países donde está aprobado".
"Nos habíamos hecho ilusión", ha reconocido el presidente del Grupo Zeltia, insistiendo en que "no cambian las previsiones" ya que dicho pago "no estaba presupuestado". De hecho, reconoce que se mantienen sus previsiones de resultado bruto de explotación (Ebitda) positivo en 2011.
En cuanto a la aprobación de 'Yondelis', Fernández Sousa confía en que el fármaco pueda estar en el mercado estadounidense "cuanto antes" dada la eficacia que ha demostrado el fármaco, si bien admite que no saben "qué va a pasar" ya que depende de las condiciones que Johnson & Johnson acuerde con la FDA para este estudio adicional.
Actualmente Pharma Mar tiene en marcha un estudio en fase IV con 'Yondelis' en la misma indicación que "podría valer como estudio pivotal" para la aprobación en Estados Unidos.
NUEVOS RESULTADOS DE SUPERVIVENCIA EN JUNIO
Además, en el próximo congreso de la Sociedad Americana de Oncología Médica (ASCO, en sus siglas en inglés) que se celebrará en Chicago en junio se van a presentar nuevos datos de supervivencia en combinación con 'Doxil', que "mejoran" los resultados de estudios previos, que mostraron que añadir 'Yondelis' a esta terapia aumentaba la mediana de supervivencia en 2,9 meses.
No obstante, Fernández Sousa reconoce que será la FDA la que tendrá que decidir si son suficientes estos estudios o se requiere una nueva investigación.
Pese a este retraso, el presidente de Zeltia ha recordado además que se está investigando el potencial de 'Yondelis' en otros tumores, como cáncer de mama o tumores pediátricos.
Asimismo, también están a la espera de la aprobación en China y Japón como tratamiento en sarcoma y ovario, para lo que se están realizando sendos estudios a fin de comprobar su eficacia en las etnias de estos países.
Los títulos de Zeltia retrocedían un 2,63% a las 14,42 horas, hasta intercambiarse a un precio de 2,590 euros, después de que ayer cerraran con un descenso del 5,51%.
El presidente del Grupo Zeltia, José María Fernández Sousa, ha asegurado que el negocio del grupo y, en concreto, de su filial Pharma Mar, no se verán afectados por el retraso de la aprobación del fármaco 'Yondelis' en Estados Unidos, después de que la Agencia Americana del Medicamento (FDA, en sus siglas en inglés) haya pedido un estudio adicional antes de dar luz verde definitiva al uso de este fármaco frente al cáncer de ovario.
Asimismo, tampoco prevé que esta decisión afecte a las ventas de 'Yondelis' en aquellos países donde ya está autorizado, que alcanzaron los 19,6 millones de euros en marzo de 2011 (frente a los 16,6 millones en marzo de 2010).
El pasado viernes, Centocor Ortho Biotech Products, filial del grupo estadounidense Johnson & Johnson, decidió retirar la solicitud de comercialización de 'Yondelis' en Estados Unidos como tratamiento en segunda línea contra el cáncer de ovario en combinación con 'Doxil'.
En las expectativas de Johnson & Johnson y Zeltia estaba que el fármaco pudiese recibir la aprobación definitiva en noviembre de este año, lo que conllevaba además un pago a la biofarmacéutica española de 10 millones de dólares (6,84 millones de euros al cambio actual).
Sin embargo, y pese a que dicho pago se retrasa hasta que se produzca la autorización, Fernández Sousa afirma que "se trata de un pago extraordinario, que no afectará al negocio recurrente de la compañía ya que depende de los países donde está aprobado".
"Nos habíamos hecho ilusión", ha reconocido el presidente del Grupo Zeltia, insistiendo en que "no cambian las previsiones" ya que dicho pago "no estaba presupuestado". De hecho, reconoce que se mantienen sus previsiones de resultado bruto de explotación (Ebitda) positivo en 2011.
En cuanto a la aprobación de 'Yondelis', Fernández Sousa confía en que el fármaco pueda estar en el mercado estadounidense "cuanto antes" dada la eficacia que ha demostrado el fármaco, si bien admite que no saben "qué va a pasar" ya que depende de las condiciones que Johnson & Johnson acuerde con la FDA para este estudio adicional.
Actualmente Pharma Mar tiene en marcha un estudio en fase IV con 'Yondelis' en la misma indicación que "podría valer como estudio pivotal" para la aprobación en Estados Unidos.
NUEVOS RESULTADOS DE SUPERVIVENCIA EN JUNIO
Además, en el próximo congreso de la Sociedad Americana de Oncología Médica (ASCO, en sus siglas en inglés) que se celebrará en Chicago en junio se van a presentar nuevos datos de supervivencia en combinación con 'Doxil', que "mejoran" los resultados de estudios previos, que mostraron que añadir 'Yondelis' a esta terapia aumentaba la mediana de supervivencia en 2,9 meses.
No obstante, Fernández Sousa reconoce que será la FDA la que tendrá que decidir si son suficientes estos estudios o se requiere una nueva investigación.
Pese a este retraso, el presidente de Zeltia ha recordado además que se está investigando el potencial de 'Yondelis' en otros tumores, como cáncer de mama o tumores pediátricos.
Asimismo, también están a la espera de la aprobación en China y Japón como tratamiento en sarcoma y ovario, para lo que se están realizando sendos estudios a fin de comprobar su eficacia en las etnias de estos países.
Los títulos de Zeltia retrocedían un 2,63% a las 14,42 horas, hasta intercambiarse a un precio de 2,590 euros, después de que ayer cerraran con un descenso del 5,51%.
Zeltia . el grupo farmacéutico tiene previstos otros extraordinarios para este año, alguno incluso superior a 10 millones de dólares .
Zeltia confía en que el retraso de Yondelis en EEUU no afecte a sus cuentas .
Madrid, 3 may (EFECOM).- Zeltia espera que Johnson & Johnson presente a las autoridades estadounidenses un dossier "más robusto" para lograr que Yondelis se apruebe en EEUU como medicamento para el cáncer de ovarios y confía en que la suspensión temporal en este país no afecte a su comercialización en Europa ni a sus resultados.
Así lo manifestó el presidente del grupo Zeltia, José María Fernández Sousa, después de que la multinacional americana retirase de forma voluntaria la solicitud de inscripción que presentó en 2008 ante la Administración de Fármacos y Alimentos (FDA) de EEUU para Yondelis, fármaco que desarrolla la filial de Zeltia PharmaMar.
Una decisión que responde al ensayo adicional que la FDA ha exigido a Johnson & Johnson para obtener finalmente la aprobación de Yondelis en el mercado estadounidense.
Fernández Sousa aseguró desconocer cuándo se presentará de nuevo la solicitud de nuevo fármaco para Yondelis, sin embargo agregó que el proceso podría suponer un retraso de hasta dos años.
Con respecto al pago de 10 millones de dólares (unos 6,84 millones de euros) que Johnson & Johnson debía pagar en diciembre a PharmaMar una vez que se aprobara Yondelis por la FDA, el presidente de Zeltia aseguró que este retraso no afectará a las cuentas de la compañía, ya que este pago se había incluido como extraordinario.
En este sentido, anunció que, a pesar de la "ilusión" que tenía puesta la compañía en esta fase, el grupo farmacéutico tiene previstos otros extraordinarios para este año, alguno incluso superior a 10 millones de dólares, agregó.
Asimismo, Zeltia mantiene su objetivo de lograr un beneficio bruto de explotación positivo a lo largo de este año.
Con respecto a la evolución de las ventas de la compañía, el presidente de Zeltia subrayó que la facturación de Yondelis en aquellos países en los que está aprobado el producto "cada vez va a más" y destacó la buena acogida del producto como tratamiento a los sarcomas y al cáncer de ovario.
Yondelis está aprobado en 63 países, 33 de ellos fuera del espacio económico europeo -sin contar el mercado estadounidense-, del chino (que a penas supone el 3 % del mercado oncológico mundial) y del japonés, un país en el que actualmente se está estudiando el comportamiento de Yondelis en la etnia oriental.
Atendiendo a las otras aplicaciones de Yondelis, Fernandez Sousa, recordó que se está estudiando su aplicación en los tratamientos de cáncer de mama y de próstata, así como en los tumores pediátricos.
Madrid, 3 may (EFECOM).- Zeltia espera que Johnson & Johnson presente a las autoridades estadounidenses un dossier "más robusto" para lograr que Yondelis se apruebe en EEUU como medicamento para el cáncer de ovarios y confía en que la suspensión temporal en este país no afecte a su comercialización en Europa ni a sus resultados.
Así lo manifestó el presidente del grupo Zeltia, José María Fernández Sousa, después de que la multinacional americana retirase de forma voluntaria la solicitud de inscripción que presentó en 2008 ante la Administración de Fármacos y Alimentos (FDA) de EEUU para Yondelis, fármaco que desarrolla la filial de Zeltia PharmaMar.
Una decisión que responde al ensayo adicional que la FDA ha exigido a Johnson & Johnson para obtener finalmente la aprobación de Yondelis en el mercado estadounidense.
Fernández Sousa aseguró desconocer cuándo se presentará de nuevo la solicitud de nuevo fármaco para Yondelis, sin embargo agregó que el proceso podría suponer un retraso de hasta dos años.
Con respecto al pago de 10 millones de dólares (unos 6,84 millones de euros) que Johnson & Johnson debía pagar en diciembre a PharmaMar una vez que se aprobara Yondelis por la FDA, el presidente de Zeltia aseguró que este retraso no afectará a las cuentas de la compañía, ya que este pago se había incluido como extraordinario.
En este sentido, anunció que, a pesar de la "ilusión" que tenía puesta la compañía en esta fase, el grupo farmacéutico tiene previstos otros extraordinarios para este año, alguno incluso superior a 10 millones de dólares, agregó.
Asimismo, Zeltia mantiene su objetivo de lograr un beneficio bruto de explotación positivo a lo largo de este año.
Con respecto a la evolución de las ventas de la compañía, el presidente de Zeltia subrayó que la facturación de Yondelis en aquellos países en los que está aprobado el producto "cada vez va a más" y destacó la buena acogida del producto como tratamiento a los sarcomas y al cáncer de ovario.
Yondelis está aprobado en 63 países, 33 de ellos fuera del espacio económico europeo -sin contar el mercado estadounidense-, del chino (que a penas supone el 3 % del mercado oncológico mundial) y del japonés, un país en el que actualmente se está estudiando el comportamiento de Yondelis en la etnia oriental.
Atendiendo a las otras aplicaciones de Yondelis, Fernandez Sousa, recordó que se está estudiando su aplicación en los tratamientos de cáncer de mama y de próstata, así como en los tumores pediátricos.
Zeltia.En 2 meses termina el Blindaje.Sousa comunica que no posee una bola de cristal al respecto.Ventas Yondelis en Eu deben tranquilizar accionistas
El presidente afirma que habrá novedades a lo largo del año .
“No tenemos una bola de cristal, así que no sabemos qué va a pasar”, ha respondido José María Fernández Sousa, presidente de Zeltia, a la pregunta que le hemos formulado en torno a los cambios que se producirán dentro de dos meses, cuando se termine el blindaje de los derechos de voto que hasta ahora los limitaba al 10% independientemente del porcentaje de acciones qué ostentaran los accionistas. Se muestra tranquilo y prefiere hablar de las bondades del Yondelis, que ayer sufrió un “pequeño revés” al saberse que J&J ha decidido retirar de la FDA la solicitud de nuevo fármaco.
Tanto Sousa como Luis Mora, director general de Pharma Mar, no están preocupados por este contratiempo. Aseguran que se debe a los requisitos que ha solicitado la FDA, mucho más exigente que la EMEA, pero que es un tema que depende mucho más de J&J que de ellos (“no lo han rechazado, simplemente han solicitado más información”). Afirman que ya no se cumplirá el calendario previsto –aprobación a finales de año- pero que eso no provoca un cambio de previsiones, pues Yondelis se trata de un beneficio extraordinario. “Sabremos más del calendario a lo largo del año, pero mantenemos nuestra previsión de EBITDA positivo para 2011 porque lo que de verdad cuenta es el negocio recurrente”, han dicho.
Para que los accionistas estén tranquilos, afirman que las ventas del Yondelis en Europa están avanzando satisfactoriamente. “Yondelis es un buen fármaco, y hay estudios muy positivos, que presentaremos en junio tanto en Europa como en EE.UU., que demuestran que la supervivencia de los pacientes alcanza los 2,9 meses”.
Asimismo, y para mitigar el impacto de este retraso, reconocen que tienen otros proyectos en desarrollo. Ya se encuentran en estudios de Fase III para el uso del Yondelis en la primera línea de sarcomas, con buen resultado, y también han lanzado un estudio para la aplicación del fármaco en el cáncer de mama y en tumores pediátricos. “Tenemos muchos estudios en marcha, pero daremos prioridad a la investigación del Yondelis en cánceres de mama y pediátricos”.
“No tenemos una bola de cristal, así que no sabemos qué va a pasar”, ha respondido José María Fernández Sousa, presidente de Zeltia, a la pregunta que le hemos formulado en torno a los cambios que se producirán dentro de dos meses, cuando se termine el blindaje de los derechos de voto que hasta ahora los limitaba al 10% independientemente del porcentaje de acciones qué ostentaran los accionistas. Se muestra tranquilo y prefiere hablar de las bondades del Yondelis, que ayer sufrió un “pequeño revés” al saberse que J&J ha decidido retirar de la FDA la solicitud de nuevo fármaco.
Tanto Sousa como Luis Mora, director general de Pharma Mar, no están preocupados por este contratiempo. Aseguran que se debe a los requisitos que ha solicitado la FDA, mucho más exigente que la EMEA, pero que es un tema que depende mucho más de J&J que de ellos (“no lo han rechazado, simplemente han solicitado más información”). Afirman que ya no se cumplirá el calendario previsto –aprobación a finales de año- pero que eso no provoca un cambio de previsiones, pues Yondelis se trata de un beneficio extraordinario. “Sabremos más del calendario a lo largo del año, pero mantenemos nuestra previsión de EBITDA positivo para 2011 porque lo que de verdad cuenta es el negocio recurrente”, han dicho.
Para que los accionistas estén tranquilos, afirman que las ventas del Yondelis en Europa están avanzando satisfactoriamente. “Yondelis es un buen fármaco, y hay estudios muy positivos, que presentaremos en junio tanto en Europa como en EE.UU., que demuestran que la supervivencia de los pacientes alcanza los 2,9 meses”.
Asimismo, y para mitigar el impacto de este retraso, reconocen que tienen otros proyectos en desarrollo. Ya se encuentran en estudios de Fase III para el uso del Yondelis en la primera línea de sarcomas, con buen resultado, y también han lanzado un estudio para la aplicación del fármaco en el cáncer de mama y en tumores pediátricos. “Tenemos muchos estudios en marcha, pero daremos prioridad a la investigación del Yondelis en cánceres de mama y pediátricos”.
Esa larga y penosa enfermedad .
Todavía se ve frecuentemente. Esquelas y obituarios culpando de la muerte del finado a una "larga y penosa" enfermedad. Un eufemismo absurdo de algo tan frecuente como el cáncer. En todos los periódicos de calidad en Estados Unidos, cuando se comunica que una persona ha muerto se recalca el porqué. Allí nunca se obvia que la razón fue el cáncer y hasta se detalla el tipo de tumor.
Sin embargo, en nuestro país todavía hay periodistas que recurren con frecuencia a este tópico. Titulan o hablan en sus crónicas de "el cáncer del deporte", "de la política" o "de la economía". Lo hacen insensibles a lo que les molesta a los pacientes con esta enfermedad ese recurso fácil. Lo hacen porque ni tienen esa patología, ni la entienden, ni en su entorno existe alguien con ella.
El cáncer es una enfermedad corriente. Tanto o más que cualquiera de las más conocidas y, aparentemente, menos graves. Seria y mortal en muchas ocasiones, pero no más que otras como, por ejemplo, la insuficiencia cardiaca. Su letalidad ya es inferior al 50% y es un problema crónico en un amplio porcentaje de las veces. Como lo es la diabetes, la hipertensión, la obesidad o el asma.
...
Sin embargo, en nuestro país todavía hay periodistas que recurren con frecuencia a este tópico. Titulan o hablan en sus crónicas de "el cáncer del deporte", "de la política" o "de la economía". Lo hacen insensibles a lo que les molesta a los pacientes con esta enfermedad ese recurso fácil. Lo hacen porque ni tienen esa patología, ni la entienden, ni en su entorno existe alguien con ella.
El cáncer es una enfermedad corriente. Tanto o más que cualquiera de las más conocidas y, aparentemente, menos graves. Seria y mortal en muchas ocasiones, pero no más que otras como, por ejemplo, la insuficiencia cardiaca. Su letalidad ya es inferior al 50% y es un problema crónico en un amplio porcentaje de las veces. Como lo es la diabetes, la hipertensión, la obesidad o el asma.
...
02 mayo 2011
01 mayo 2011
Trabectedin has a low cardiac risk profile: a comprehensive cardiac safety analysis.Opinion de Sousa Y Mora tras las decisiones de la FDA y EMEA 2009.
CONCLUSIONS
► Trabectedin non-clinical studies found no relevant macroscopic, microscopic or functional cardiac alterations with any evidence of cardiotoxicity or cardiac end-organ toxicity.
► In phase I, II and III trials evaluating trabectedin as monotherapy or in combination with doxorubicin or PLD, tachycardia or palpitations were the most common cardiac AE, without associated LVEF changes or clinical sequelae. Other types of cardiac events were infrequent.
► A comprehensive review of all existing trabectedin data indicates a low cardiac risk for trabectedin with a low overall incidence of cardiac events.
...Este Abstrac fue presentado en el Ultimo Congreso ESMO y el pòsterior comunicado sobre lo alli presentado :
Tres análisis confirman el perfil de seguridad bien caracterizado y controlable de Yondelis® (trabectedina):
Se ha analizado la tolerabilidad de trabectedina más doxorrubicina liposómica pegilada (DLP) en pacientes con cáncer de ovario recurrente sensible y platino resistente. Los datos de seguridad final se evaluaron en 663 pacientes tratados que recibieron una o más dosis de trabectedina o DLP. Este análisis demostró que la combinación de trabectedina más doxorrubicina liposómica pegilada era bien tolerada y manejable. No se asociaron efectos secundarios como neuropatía periférica y alopecia.
Una revisión exhaustiva del perfil de seguridad cardiaco de Yondelis® administrado en ensayos clínicos como monoterapia o en combinación con antraciclinas, y durante la experiencia posterior a la comercialización, indica que trabectedina presenta una muy baja incidencia general de estos eventos cardiacos. Muchos de estos eventos consistieron en taquicardia y palpitaciones, sin cambios asociados en la fracción de inyección ventricular izquierda ni secuelas clínicas. Otros eventos cardiacos fueron infrecuentes confirmando esta extensa revisión de datos el bajo riesgo cardiaco asociado al tratamiento con trabectedina.
En un análisis combinado de 19 ensayos clínicos en fase II con Yondelis® que incluía a 1.132 pacientes con tumores sólidos se concluyó que la trabectedina si bien induce habitualmente elevaciones transitorias y reversibles de transaminasas, estas elevaciones son fácilmente controlables y con bajas tasas de interrupción de los tratamientos, lo que refleja una respuesta adaptativa del huésped.
**************************************************++
2009 : siempre se dijo que el ensayo OVA 301 habia sido pactado entre la FDA y J&J en cuanto a los resultados a obtener ... pero la FDA cuando llego el día pidio más datos y la EMEA en cambio lo aprobo ...
Lo que dijo el Director de Pharma Mar al respecto de esas decisiones del 2009 :
–El ensayo clínico OVA-031 cumplió los objetivos marcados y acordados con las autoridades, sin toxicidades limitantes y con un balance beneficio-riesgo positivo. En consecuencia, no había razón para no ser optimistas.
–¿Cómo se explica que la FDA haya requerido más datos para evaluar la aprobación para la comercialización de Yondelis ® para cáncer de ovario y, sin embargo, la EMEA haya dado luz verde en Europa por unanimidad?
–La FDA y la EMEA tienen procesos regulatorios diferentes. Además, ante la FDA los datos fueron presentados por nuestro socio, Centocor Ortho Biotech, filial de Johnson & Johnson, y ante la EMEA por nosotros. Los datos que tenían ambas agencias eran los mismos. Sin embargo, los análisis y los datos que fueron suministrados con posterioridad a la presentación del dossier sí que fueron evaluados y tenidos en cuenta por la EMEA y no así por la FDA, de forma que ésta no dispuso de todos los datos actualizados.
–¿Por qué les sorprendió esta decisión de la FDA?
–Porque los objetivos del ensayo habían sido acordados con ellos y, sorprendentemente, obviaron este acuerdo y no les bastó con el dato positivo de PFS (progression-free survival) y el trend positivo de OS (overall survival). Ahora quieren datos más maduros de OS. Sin embargo, la FDA ya cuenta con esos datos más maduros que avalarían una aprobación, todo ello sin olvidar que tienen los resultados de un ensayo que ellos mismos solicitaron expresamente a nuestro socio sobre toxicidad cardíaca. Un estudio llevado a cabo con 70 pacientes en el que se demostró que ninguno presentaba toxicidades cardíacas derivadas de la administración de Yondelis® .
************************************
Lo que dijo Sousa al respecto de la decision de la FDA y la EMEA en 2009 :
Dos semanas después de que la FDA rechazara la comercialización de Yondelis (desarrollado en Europa por Zeltia y en Estados Unidos por la fi lial de Johnson & Johnson Centocor Ortho Biotech), la EMEA ha decidido justo lo contrario: que los datos de supervivencia son positivos, que la toxicidad es la habitual en un fármaco de estas características, que el tratamiento ha pasado con éxito los ensayos clínicos y que debe comercializarse contra el cáncer de ovario.
Pero lo sorprendente del caso radica en las votaciones. Si el panel de expertos de enfermedades oncológicos (ODAC) rechazó en su mayoría el fármaco, todos los especialistas de la EMEA votaron a favor del medicamento. ¿Por qué esa diferencia
de criterio? ¿Por qué un rechazo o una aprobación tan absolutos?
El presidente de Zeltia, José María Fernández Sousa-Faro, está convencido del motivo: “Se le ocultaron datos al ODAC”.
En Estados Unidos, el caso no ha pasado desapercibido. Las asociaciones de pacientes estadounidenses han puesto el grito en el cielo para reclamar un sistema de aprobación de medicamentos más justo. EL ODAC tomó la decisión sin tener en cuenta un ensayo especial sobre la toxicidad del fármaco que la propia FDA encargó a Johnson & Johnson.
El diario económico Wall Street Journal recogía la semana pasada un artículo del presidente de la Fundación de América contra el Sarcoma y miembro fundador de la Organización Nacional contra Cánceres poco comunes, en el que denunciaba el contrasentido del rechazo del medicamento y señalaba un culpable: Richard Pazdur, director de cáncer de la FDA: “Influyó de manera importante en los miembros del ODAC. Es como si a un fiscal le permitieran elegir a sus amigos para el jurado.
Cuando el ODAC actúa al mismo paso que la FDA, es razonable cuestionar la justicia del sistema”.
Sin ir más lejos, acusaba a la FDA de “negar a las mujeres de una opción viable para luchar contra el cáncer de ovario”.
► Trabectedin non-clinical studies found no relevant macroscopic, microscopic or functional cardiac alterations with any evidence of cardiotoxicity or cardiac end-organ toxicity.
► In phase I, II and III trials evaluating trabectedin as monotherapy or in combination with doxorubicin or PLD, tachycardia or palpitations were the most common cardiac AE, without associated LVEF changes or clinical sequelae. Other types of cardiac events were infrequent.
► A comprehensive review of all existing trabectedin data indicates a low cardiac risk for trabectedin with a low overall incidence of cardiac events.
...Este Abstrac fue presentado en el Ultimo Congreso ESMO y el pòsterior comunicado sobre lo alli presentado :
Tres análisis confirman el perfil de seguridad bien caracterizado y controlable de Yondelis® (trabectedina):
Se ha analizado la tolerabilidad de trabectedina más doxorrubicina liposómica pegilada (DLP) en pacientes con cáncer de ovario recurrente sensible y platino resistente. Los datos de seguridad final se evaluaron en 663 pacientes tratados que recibieron una o más dosis de trabectedina o DLP. Este análisis demostró que la combinación de trabectedina más doxorrubicina liposómica pegilada era bien tolerada y manejable. No se asociaron efectos secundarios como neuropatía periférica y alopecia.
Una revisión exhaustiva del perfil de seguridad cardiaco de Yondelis® administrado en ensayos clínicos como monoterapia o en combinación con antraciclinas, y durante la experiencia posterior a la comercialización, indica que trabectedina presenta una muy baja incidencia general de estos eventos cardiacos. Muchos de estos eventos consistieron en taquicardia y palpitaciones, sin cambios asociados en la fracción de inyección ventricular izquierda ni secuelas clínicas. Otros eventos cardiacos fueron infrecuentes confirmando esta extensa revisión de datos el bajo riesgo cardiaco asociado al tratamiento con trabectedina.
En un análisis combinado de 19 ensayos clínicos en fase II con Yondelis® que incluía a 1.132 pacientes con tumores sólidos se concluyó que la trabectedina si bien induce habitualmente elevaciones transitorias y reversibles de transaminasas, estas elevaciones son fácilmente controlables y con bajas tasas de interrupción de los tratamientos, lo que refleja una respuesta adaptativa del huésped.
**************************************************++
2009 : siempre se dijo que el ensayo OVA 301 habia sido pactado entre la FDA y J&J en cuanto a los resultados a obtener ... pero la FDA cuando llego el día pidio más datos y la EMEA en cambio lo aprobo ...
Lo que dijo el Director de Pharma Mar al respecto de esas decisiones del 2009 :
–El ensayo clínico OVA-031 cumplió los objetivos marcados y acordados con las autoridades, sin toxicidades limitantes y con un balance beneficio-riesgo positivo. En consecuencia, no había razón para no ser optimistas.
–¿Cómo se explica que la FDA haya requerido más datos para evaluar la aprobación para la comercialización de Yondelis ® para cáncer de ovario y, sin embargo, la EMEA haya dado luz verde en Europa por unanimidad?
–La FDA y la EMEA tienen procesos regulatorios diferentes. Además, ante la FDA los datos fueron presentados por nuestro socio, Centocor Ortho Biotech, filial de Johnson & Johnson, y ante la EMEA por nosotros. Los datos que tenían ambas agencias eran los mismos. Sin embargo, los análisis y los datos que fueron suministrados con posterioridad a la presentación del dossier sí que fueron evaluados y tenidos en cuenta por la EMEA y no así por la FDA, de forma que ésta no dispuso de todos los datos actualizados.
–¿Por qué les sorprendió esta decisión de la FDA?
–Porque los objetivos del ensayo habían sido acordados con ellos y, sorprendentemente, obviaron este acuerdo y no les bastó con el dato positivo de PFS (progression-free survival) y el trend positivo de OS (overall survival). Ahora quieren datos más maduros de OS. Sin embargo, la FDA ya cuenta con esos datos más maduros que avalarían una aprobación, todo ello sin olvidar que tienen los resultados de un ensayo que ellos mismos solicitaron expresamente a nuestro socio sobre toxicidad cardíaca. Un estudio llevado a cabo con 70 pacientes en el que se demostró que ninguno presentaba toxicidades cardíacas derivadas de la administración de Yondelis® .
************************************
Lo que dijo Sousa al respecto de la decision de la FDA y la EMEA en 2009 :
Dos semanas después de que la FDA rechazara la comercialización de Yondelis (desarrollado en Europa por Zeltia y en Estados Unidos por la fi lial de Johnson & Johnson Centocor Ortho Biotech), la EMEA ha decidido justo lo contrario: que los datos de supervivencia son positivos, que la toxicidad es la habitual en un fármaco de estas características, que el tratamiento ha pasado con éxito los ensayos clínicos y que debe comercializarse contra el cáncer de ovario.
Pero lo sorprendente del caso radica en las votaciones. Si el panel de expertos de enfermedades oncológicos (ODAC) rechazó en su mayoría el fármaco, todos los especialistas de la EMEA votaron a favor del medicamento. ¿Por qué esa diferencia
de criterio? ¿Por qué un rechazo o una aprobación tan absolutos?
El presidente de Zeltia, José María Fernández Sousa-Faro, está convencido del motivo: “Se le ocultaron datos al ODAC”.
En Estados Unidos, el caso no ha pasado desapercibido. Las asociaciones de pacientes estadounidenses han puesto el grito en el cielo para reclamar un sistema de aprobación de medicamentos más justo. EL ODAC tomó la decisión sin tener en cuenta un ensayo especial sobre la toxicidad del fármaco que la propia FDA encargó a Johnson & Johnson.
El diario económico Wall Street Journal recogía la semana pasada un artículo del presidente de la Fundación de América contra el Sarcoma y miembro fundador de la Organización Nacional contra Cánceres poco comunes, en el que denunciaba el contrasentido del rechazo del medicamento y señalaba un culpable: Richard Pazdur, director de cáncer de la FDA: “Influyó de manera importante en los miembros del ODAC. Es como si a un fiscal le permitieran elegir a sus amigos para el jurado.
Cuando el ODAC actúa al mismo paso que la FDA, es razonable cuestionar la justicia del sistema”.
Sin ir más lejos, acusaba a la FDA de “negar a las mujeres de una opción viable para luchar contra el cáncer de ovario”.
Descubren el mecanismo que relaciona la progesterona y el cáncer de mama hereditario .
Investigadores del Centro de Regulación Genómica (CRG) en Barcelona han descubierto un nuevo mecanismo que relaciona la progesterona con el cáncer de mama hereditario, y que podría conllevar cambios en la prescripción de los tratamientos anticonceptivos.
El trabajo, que publica la revista Cancer Research, constata que el mayor crecimiento de células cancerosas con defectos de BRCA1 se debe a dos factores, al aumento de la cantidad de receptor de progesterona que se encuentra en las células, y por su mayor efecto sobre la expresión de genes que activan la proliferación celular.
...
El trabajo, que publica la revista Cancer Research, constata que el mayor crecimiento de células cancerosas con defectos de BRCA1 se debe a dos factores, al aumento de la cantidad de receptor de progesterona que se encuentra en las células, y por su mayor efecto sobre la expresión de genes que activan la proliferación celular.
...
Resultados positivos avalan 'Zaltrap' (Sanofi-aventis y Regeneron) para cáncer colorrectal metastásico en Tratamientos de segunda linea .
Sanofi-aventis y Regeneron Pharmaceuticals han adelantado este miércoles que los resultados del último estudio Fase III, que ha evaluado el aumento de supervivencia global del agente de investigación aflibercept, también conocido como el VEGF Trap, y registrado como 'Zaltrap', como tratamiento de segunda línea para cáncer colorrectal metastásico, han sido positivos.
...
...
Suscribirse a:
Comentarios (Atom)







