VANCOUVER, Columbia Británica--(BUSINESSWIRE)--AbCellera(Nasdaq: ABCL) y colaboradores anunciaron hoy la publicación de una investigación en Science Translational Medicine que caracteriza la alta potencia de bamlanivimab (LY-CoV555) para neutralizar la RAES-CoV-2 uniendo de forma única las confirmaciones arriba y abajo del dominio de unión a receptores de pico (RBD) e inhibiendo las interacciones críticas con el receptor celular de conversión de angiotensina 2 (ACE2) necesario para la entrada viral. Los datos generados en un modelo preclínico mostraron que el tratamiento profiláctico con bamlanivimab dio lugar a disminuciones significativas en la carga viral y la replicación en las vías respiratorias superior e inferior después de la exposición SARS-CoV-2, lo que indica el potencial de bamlanivimab para reducir el desprendimiento y la transmisión virales. Estos datos, que fueron generados antes de iniciar ensayos clínicos en junio de 2020 y publicados hoy, respaldan la eficacia clínica sustancial observada de bamlanivimab en el tratamiento y la prevención del COVID-19.
"Los datos publicados hoy dan una idea de por qué bamlanivimab es tan potente y apoyan aún más toda nuestra experiencia clínica y datos que muestran que bamlanivimab es una terapia segura y eficaz para tratar y prevenir el COVID-19, cuando se administra temprano en el curso de la infección"
Resultados de ensayos clínicos reportados previamente
Bamlanivimab ha sido evaluado tanto solo como junto con otros anticuerpos en más de 5.000 pacientes en múltiples ensayos clínicos y actualmente está autorizado en más de 15 países. Bamlanivimab solo frente a placebo ha demostrado reducir la hospitalización en un 70% en pacientes de alto riesgo con infección temprana por COVID-193 y reducir el riesgo de contraer COVID-19 hasta en un 80% en residentes de hogares de ancianos cuando se utilizan como profilácticos.4
Debido a su potencia, bamlanivimab también proporciona una base terapéutica para ser administrado con otros anticuerpos para ampliar la protección contra variantes virales. El primero de ellos, bamlanivimab junto con etesevimab, ha sido autorizado en los EE.UU. y dentro de la Unión Europea, y los datos de fase 3 muestran que esta terapia de anticuerpos reduce las hospitalizaciones relacionadas con covid-19 y la muerte en un 87%.5 Lo más importante, en todos los ensayos clínicos, todas las muertes relacionadas con COVID-19 ocurrieron en pacientes que tomaron el placebo; no se produjeron muertes en pacientes que recibieron una terapia con anticuerpos, ya sea solo bamlanivimab o junto con otro anticuerpo.5
"Al comienzo de nuestra respuesta pandémica al COVID-19, tomamos la decisión con nuestros socios y colaboradores de desarrollar un solo anticuerpo, haciendo hincapié en la velocidad y la escalabilidad para que pudiéramos ayudar al mayor número posible de personas", dijo Carl Hansen, Ph.D., CEO y Presidente de AbCellera. "En los últimos cuatro meses, bamlanivimab se ha utilizado para tratar a cientos de miles de personas en todo el mundo, más que cualquier otra terapia de anticuerpos COVID-19. Creemos que esto ha mantenido a miles de personas fuera del hospital, reduciendo la carga sobre nuestros sistemas de salud y, lo más importante, ha salvado miles de vidas".
Discusión de los datos publicados hoy en Science Translational Medicine
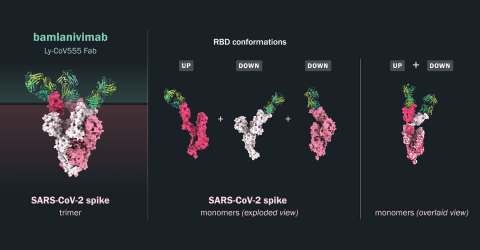
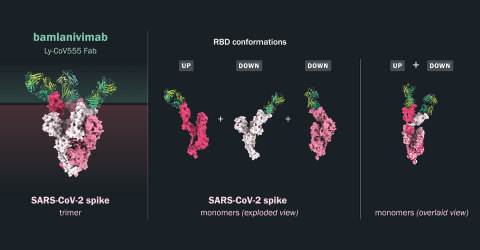
Los datos de múltiples ensayos in vitro de los 24 anticuerpos de plomo identificados por AbCellera y colaboradores indicaron que bamlanivimab mostró una mayor potencia de neutralización a pesar de afinidades similares que unen RBD, lo que sugiere que bamlanivimab tiene un perfil de unión único a la proteína de pico SARS-CoV-2. Los análisis estructurales mediante cristalografía de rayos X y microscopía electrónica demostraron que bamlanivimab se une a un área de la proteína spike superpuesta al sitio de unión ACE2 que se predice que es totalmente accesible tanto en las conformaciones ascendentes como descendentes. La porción rbd de la proteína de pico es el objetivo principal para la neutralización del virus, ya que media el mecanismo conservado de entrada viral para infectar las células. El pico existe en una posición hacia arriba o hacia abajo, con la posición hacia arriba que permite la interacción con el receptor ACE2 y la posición descendente que potencialmente contribuye a la evasión del sistema inmune. Independientemente del estado de la proteína spike, bamlanivimab tiene alta potencia de unión a la RBD de la proteína de pico SARS-CoV-2.
"La capacidad única de bamlanivimab para unir la proteína de pico tanto en la posición de arriba como hacia abajo podría subyacer a la mayor potencia de neutralización de bamlanivimab en comparación con otros anticuerpos", dijo Bo Barnhart, Ph.D., Director Científico de AbCellera. "Estos datos preclínicos muestran que las modestas dosis de bamlanivimab proporcionaron protección contra la infección por SARS-CoV-2, que desde entonces se ha confirmado en ensayos clínicos para proteger a los residentes y al personal en centros de atención a largo plazo y hogares de ancianos. Los anticuerpos neutralizantes, como el bamlanivimab, están diseñados para proteger a nuestras poblaciones más vulnerables para las que las vacunas son menos eficaces. Estos datos con bamlanivimab confirman además que los anticuerpos neutralizantes tienen el potencial de reducir la transmisión viral SARS-CoV-2 y prevenir la infección y pueden proporcionar un beneficio inmediato cuando se necesita un tratamiento que salve vidas."
Para determinar el potencial de neutralizar anticuerpos para prevenir la infección por SARS-CoV-2, los primates no humanos (PNP) fueron tratados profilácticamente con 1, 2,5, 15 o 50 mg/kg de bamlanivimab 24 horas antes del desafío viral. Críticamente, la replicación viral, así como la carga viral se redujeron significativamente en las vías respiratorias superiores el día 1 a múltiples dosis. Además, la carga viral y la replicación se redujeron significativamente o fueron indetectables en las vías respiratorias inferiores a varias dosis. A dosis de 2,5 mg/kg y concentraciones séricas más altas se asociaron con la máxima protección en este modelo.
"Los datos publicados hoy dan una idea de por qué bamlanivimab es tan potente y apoyan aún más toda nuestra experiencia clínica y datos que muestran que bamlanivimab es una terapia segura y eficaz para tratar y prevenir el COVID-19, cuando se administra temprano en el curso de la infección", dijo Ester Falconer, Ph.D., Director de Tecnología de AbCellera y autor principal del artículo. "Además, la potencia única de bamlanivimab permite una dosis más baja y permite la administración con otro anticuerpo para abordar las variantes SARS-CoV-2. Durante el último año, hemos continuado examinando muestras de pacientes, identificando miles de anticuerpos humanos y generando enormes cantidades de información sobre cómo el sistema inmunitario humano responde al COVID-19. Hemos seguido de cerca las variantes e identificado un anticuerpo de próxima generación que se predice neutraliza todas las cepas variantes circulantes de preocupación del SARS-CoV-2. Este anticuerpo, actualmente conocido como 1404, se trasladó al desarrollo preclínico y la fabricación en enero con nuestro socio, Eli Lilly and Company, y seguimos trabajando estrechamente con ellos y nuestros colaboradores para un rápido avance".
Los datos preclínicos de bamlanivimab se publicaron hoy en línea en Science Translational Medicine y se pueden encontrar en: https://science.sciencemag.org/lookup/doi/10.1126/science.abf1906.