Si Algo se Sabe o se Da Por Seguro Por Tod@s los Inversores, Ya se Ha Descontado en el Precio de la Acción o Activo ... Todo Inversor Experimentado lo Lleva Tatuado : “ BUY THE RUMOR , SELL THE NEWS ” .
17 febrero 2023
Did the European Medicines Agency Limit Covid Drug Treatment Research Options? .
At The Outset of Covid, Many Pharmaceutical Companies Sought To Repurpose Drug Treatments they Had Already Developed To Fight Covid .
It was reported in November in the EU Reporter that Aplidin, a drug made by global onocology lab PharmaMar initially for relapsed/refractory Multiple Myeloma (MM) showed promising results for treatment of adults with severe cases of COVID 19. According to PharmaMar data, the potency of Aplidin against the coronavirus was over 1000 times that of other drugs .
Although the drug was eventually approved for clinical trials, the response by the European Medicines Agency (EMA) as well as the Committee for Medicinal Products for Human Use (CHMP) and the Spanish Agency of Medicines and Medicinal Products (AEMPS) revealed concerning flaws in the approvement protocols in the Europe Union .
There is speculation that politics may have influenced the decision-making process and created obstacles for the approval of the drug. The Myeloma Patients Europe, an NGO network representing over 40 patient associations, has expressed concern about the potential denial of the drug and has written a letter to the chair of the CHMP committee. In October 2022, despite supporting evidence of Aplidin’s effectiveness and a ruling in favor of the drug by the EU courts, the EMA appears to be continuing to delay or obstruct the drug’s authorization. PharmaMar has taken the EMA to court and requested clarification on the criteria for evaluating marketing authorization procedures. Overall, there are questions about the fairness and alignment of the market authorization process with the needs of patients seeking access to life-saving treatments.
A former CHMP member Dr. Bart Van der Schueren, stated that EMA has arbitrary procedures for market authorization and that “by phrasing a question [to EMA] you can already influence the outcome” and that “[the] FDA would function better [than EMA]”.
Another member, Jorge Camarero member explained that “we can make a mistake. In fact, I believe that some, sometimes, we have been mistaken….from my point of view, there are drugs that are effective, that can prolong survival, and have not been authorised”. Camarero said that “access to the market is given to drugs that are alike,” to avoid generating too much competition. When referring to Aplidin specifically, Camarero said “There could be patients who might benefit from this drug.”
There may be a sort of conflict of interests regarding new drug treatments between the EU member states and their regulatory agency, because the member states must reimburse medical institutions for drug treatments which are regulated by the EMA and CHMP. 2-term Executive Director of EMA Thomas Lonngren explained: “The CHMP is more difficult than the FDA when decision-making on Oncology products’, and they are saying that, you know, some of the CHMP members are influenced by the member states because of reimbursement issues.”
In 2020, the General Court of the European Union granted in full the application by PharmaMar, annulling a European Commission decision. The court’s decision, and its examination of potential bias, offers some insight into the drug approval process, specifically that some of the independent experts whose testimony formed the basis of the European Commission’s decision were concurrently working on a drug treatment product that would have been a rival to Aplidin. The court recognized that these circumstances may have had an adverse effect on a supposedly neutral process. The General Court’s decision noted: “the procedure that led to the adoption of the contested decision did not provide sufficient guarantees to exclude any legitimate doubt as to possible bias.” Meanwhile, Aplidin has been approved for treatment in Australia.
It appears CHMP and EMA are lacking in proper controls to ensure independence and impartiality in their review process. If these failures are so apparent in the Aplidin decision, what other drug treatments may have been kept from the public? What other advancements in medicine may have been lost? Who had influence in the selection of experts? Were any private companies involved? .
Questions are being raised about the EMA’s practices and if or how internal regulatory bodies such as the European Ombsudsman should investigate, and how to make sure there is maximum transparency about the connections between regulatory agency staff and private institutions or businesses involved in research and development of drug treatments. Of course, the circle of experts being so small means there must occasionally be overlap, and overlap doesn’t mean there must be exclusion. Rather it is simply a reason for greater transparency, so that biases can be known and accounted for in the processes, and not unveiled only during costly lawsuits and court investigations .
PharmaMar Renuncia al Fármaco Español Contra el Covid-19 “ Ante la Falta de Pacientes ” . Post By Cinco Días .
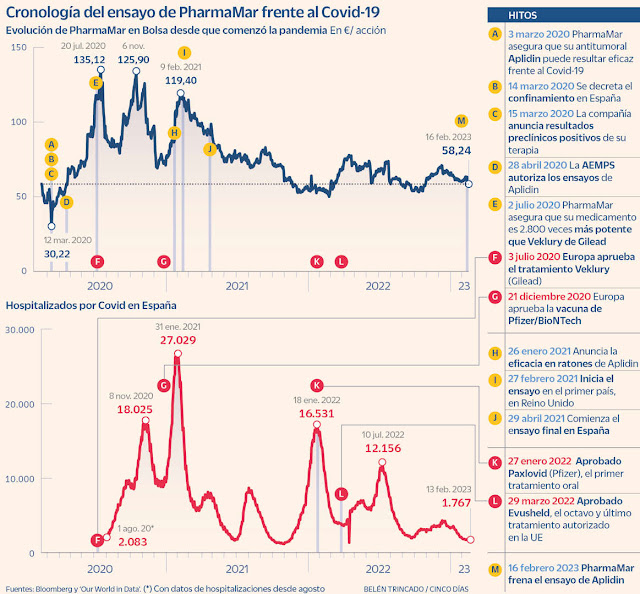
Cronología de un Fracaso .
Un Portavoz de la Empresa Indica Que Solo Han Conseguido Reclutar Alrededor de un Tercio de las Personas HOSPITALIZADAS Necesarias . ... 203 de las 609 Pacientes Previstos en el Ensayo .
Cinco Días . Alfonso Simon , 17 Febrero 2023 .
PharmaMar Ha Parado el Estudio de su Fármaco Experimental Contra el Covid-19 “Ante la Falta de Pacientes”, Según Anunció Ayer el Laboratorio Cotizado .
A pesar de ser uno de los primeros medicamentos en anunciarse en el mundo para esta enfermedad, en marzo de 2020, no ha logrado reclutar suficientes personas hospitalizadas, tal como aseguró la empresa en un hecho relevante a la Comisión Nacional del Mercado de Valores (CNMV). En ese periodo, sin embargo, ocho medicamentos han sido aprobados por la Agencia Europea del Medicamento (EMA, en sus siglas en inglés).
La Compañía española, presidida por José María Fernández Sousa-Faro, anunció el 15 de marzo de 2020, justo al inicio del confinamiento de Covid-19, que su antitumoral Aplidin (que había sido rechazado como medicamento oncológico por la EMA) daba resultados positivos en estudios preclínicos como antiviral. Como resultado, las acciones del laboratorio se dispararon ese día un 33% .
El 29 de abril de 2020, PharmaMar informó de que iniciaba los ensayos con pacientes tras recibir el visto bueno de la Agencia Española de Medicamentos y Productos Sanitarios (Aemps). En ese momento no había ningún fármaco en el mundo aprobado para hacer frente a la pandemia.
El primer tratamiento en aprobarse en Europa fue Veklury (de Gilead), un fármaco que, igual que en el caso de Aplidin, el laboratorio estadounidense reutilizó Como Antiviral Frente al SarsCov2 .Fue en Julio de 2020 y PharmaMar comunicó justo en esas fechas que su medicamento experimental era hasta 2.800 veces más potente.
Ese verano, PharmaMar consiguió marcar el máximo en Bolsa de los últimos tres años. La cotización de la compañía logró dispararse un 195% respecto a inicios de marzo de 2020, antes del anuncio de ensayos clínicos para reconvertir Aplidin en un antiviral frente al SARS-CoV-2. Ese impulso sirvió para que la empresa entrase en el Ibex 35 a finales de 2020. Desde esa noticia, el precio de las acciones de la compañía ha mejorado casi un 28%. El laboratorio se dejó ayer un 2,38% tras informar del cierre del reclutamiento de pacientes .
Primeros Resultados
En octubre de 2020, el laboratorio madrileño, cuya actividad es la comercialización de tres antitumorales, anunció resultados positivos de los primeros ensayos, en lo referente a la seguridad del compuesto .
En noviembre, la CNMV, en un caso nada habitual, pidió explicaciones a la empresa sobre los resultados positivos que había anunciado el mes anterior. La sociedad tuvo que responder a un requerimiento del supervisor en el que urgía una aclaración. La empresa de origen gallego (la antigua Zeltia) admitió que las pruebas realizadas con este medicamento no eran suficientes para concluir su eficacia, ya que hasta entonces solo se había realizado la fase I y II, donde se prueba únicamente la seguridad.
Finalmente, la compañía inició el ensayo en fase III en febrero de 2021 en Reino Unido. Y dos meses más tarde se unió España. Hasta el día de ayer, no había comunicado ningún tipo de avance ni actualización.
El estudio en fase III –la prueba de eficacia necesaria para recibir la autorización de comercialización– se planteó en 98 centros para captar 609 pacientes. Participaron hospitales de Argentina, Brasil, Bulgaria, Colombia, Francia, Grecia, México, Perú, Portugal, Rumanía, Sudáfrica y España. Un portavoz de la empresa indica que solo han conseguido reclutar alrededor de un tercio de las personas hospitalizadas necesarias. “La compañía ha tomado esta decisión ante la falta de pacientes para el reclutamiento del estudio debido a la evolución de la pandemia”, indica la empresa en la información remitida a la CNMV. Los datos de la Aemps muestran que en España PharmaMar ha realizado el ensayo en 36 hospitales. La investigación se centró en infección por Covid-19 de carácter moderado .
Otros Sí Avanzaron .
 |
Los problemas esgrimidos por el laboratorio no han supuesto una barrera para otras compañías, que avanzaron mucho más rápido que la firma de Fernández Sousa-Faro. Desde que PharmaMar anunciara el inicio de los últimos estudios clínicos, la EMA ha validado Ronapreve (noviembre de 2021), Regkirona (noviembre de 2021), Xevudy (diciembre de 2021), Roactemra (diciembre de 2021), Kineret (diciembre de 2021) y Evusheld (marzo de 2022). Además, en enero del pasado año dio luz verde a las primeras píldoras frente a la enfermedad, un tratamiento llamado Paxlovid, de Pfizer, que se ha convertido en un medicamento superventas con 18.933 millones de dólares en facturación en 2022.
La Empresa Asegura “Ina Tendencia Positiva Demostrando la Potente Actividad del Fármaco” .
No hay que olvidar que todas las autoridades sanitarias fueron en 2020, 2021 y 2022 diligentes y rápidas en evaluar (y aprobar si un medicamento aportaba eficacia) las posibles terapias ante la emergencia mundial causada por la pandemia de Covid-19 y su consecuente mortalidad, confinamiento y crisis económica.
El laboratorio reconoce que la aprobación de otros tratamientos también ha sido una razón que ha hecho mermar la opción de reclutar pacientes, ya que los médicos podrían apostar por tratamientos autorizados frente a uno experimental.
Aun así, la compañía asegura en el comunicado de ayer que un análisis preliminar sugiere “una tendencia positiva demostrando la potente actividad del fármaco”. Pero apunta a que esos datos se conocerán en una “posterior publicación”, que bien podría ser en una revista o en un congreso científico.
***************
**********
*****
**
*
Sigue toda la información de Cinco Días en Facebook, Twitter y Linkedin, o en nuestra newsletter Agenda de Cinco Días .











.jpeg)
