16 septiembre 2018
15 septiembre 2018
Olaparib ( Lynparza ) . AstraZeneca y MSD establecen una alianza estratégica de colaboración en Oncología .
Las compañías farmacéuticas AstraZeneca y MSD han firmado un acuerdo estratégico de colaboración en Oncología con el objetivo de copromocionar Lynparza (olaparib), el primer inhibidor de la poli ADP-ribosa polimerasa (PARP) aprobado en el ámbito mundial.
Esta alianza, que se basa en el acuerdo global que se hizo efectivo en julio de 2017, permitirá poner a disposición de un mayor número de pacientes los tratamientos más innovadores que suponen una diferencia real en su calidad de vida. En España, olaparib está aprobado como monoterapia para el tratamiento de mantenimiento de pacientes adultos con cáncer de ovario epitelial seroso de alto grado, de trompa de Falopio o peritoneal primario, con mutación genética BRCA, sensible a platino, en recaída, que están en respuesta a quimioterapia basada en platinoi.
Recientemente, la Agencia Europea del Medicamento (EMA) otorgó la autorización a olaparib en comprimidos para el tratamiento del cáncer de ovario en recaída sensible a platino con independencia del estado mutacional del gen BRCA. Esta nueva indicación se encuentra actualmente en fase de obtención de precio y reembolso por parte de las autoridades sanitarias españolas.
Tras la firma de este acuerdo, ambas compañías farmacéuticas desarrollarán y comercializarán olaparib conjuntamente, tanto en monoterapia como en combinación con otros fármacos. Además, cada una de ellas desarrollará y comercializará olaparib de manera independiente en combinación con sus respectivas terapias inmuno-oncológicas. ...
14 septiembre 2018
Xylazel, empresa química del Grupo PharmaMar S.A., especializada en la fabricación y comercialización de pinturas y barnices, estrena una nueva aplicación digital para los proyectos de construcción con madera.
13 Septiembre 2018 .
Xylazel ha desarrollado una nueva aplicación dirigida a los profesionales de la madera en la construcción tales como arquitectos, ingenieros o aparejadores. Contiene un simulador para orientar al profesional en el proceso desde la selección del tipo de madera a usar en su proyecto, siguiendo el Código Técnico de Edificación, pasando por el tipo de tratamiento recomendado para la madera en cada caso, hasta acceso a un presupuesto orientativo.

La aplicación es muy intuitiva y sencilla y se puede acceder desde la página web de Xylazel.
La aplicación es muy intuitiva y sencilla, se puede acceder desde la página web de Xylazel, clickando en el menú, en Prescripción o directamente entrando en: http://www.xylazel.com/simulador_prescripcion
Al acceder a la misma, se podrá elegir:
- Lugar donde estará colocada la madera con su correspondencia en la Clase de uso, y donde se puede seleccionar la que se ajuste al proyecto.
- Una vez validada la opción anterior, se accede a una nueva pantalla donde elegir el tipo de madera a utilizar.
- Una vez seleccionada, se explica el tipo de madera, protección necesaria y usos idóneos para construcción. En cada pantalla se puede confirmar y avanzar o volver a la anterior para cambiar la elección/criterio.
- Si se confirma la pantalla anterior, se accede a una nueva donde se muestra la idoneidad o no de la madera para la clase de uso. Si es adecuada, permite acceder a Ver Prescripción para los productos recomendados y Calcular presupuesto orientativo.
13 septiembre 2018
EEUU . Las Salidas a Bolsa en USA están Lideradas por Bancos Americanos que Evalúan Previamente la Empresa y el Potencial . Y se trata de un Proceso sometido a las Normas de la SEC que Implica No Dar Información que Pudiera Interferir en el Proceso.
PharmaMar Inicia los Tramites para cotizar en EEUU ... El Mayor Mercado Oncológico Mundial con una Cuota del 43 % .
Pharma Jonpi , 13 Septiembre 2018 .

Una vez se Obtengan los Permisos Pertinentes Planteara una Ampliacion de Capital para dar Entrada a Fondos e Inversores Cualificados de EEUU .
Como siempre en estos casos, las salidas a bolsa en USA están lideradas por bancos americanos que evalúan previamente la empresa y el potencial. Y se trata de un proceso sometido a las normas de la SEC que implica no dar información que pudiera interferir en el proceso.
Es lo que llevan pidiendo los inversores US especializados desde tiempo ... Poder acceder a Pharmamar con $$$ ...

Ahora lo que Conviene son Resultados , Expectativas y Hechos Reales .
El Aumento de Capital No Debería de Suponer Ningún Problema ... Más Bien al Contrario .
PharmaMar lleva años preparando el Desembarco en EEUU .
PharmaMar está en Negociaciones con Dos Compañias del Sector con el Objetivo de Comenzar Nuevos Estudios en Combinación con Inmunoterapia.
 Los Fondos e inversores especializados en Biotecnología contratan y envian a las presentaciones y reuniónes a Oncológos , Cientificos ... por lo que a fecha de hoy ya todos saben que PharmaMar , a diferencia de otras Biotecnologicas Americanas , ya tiene un Farmaco Oncológico Aprobado y otros Tres en distintas Fases Clinicas ... aparte de toda la I+D Preclinica ... 1.600 Patentes ... 200.000 Muestras ... una Filial ( SYLENTIS ) Puntera en la Nueva tecnología de RNA con un Farmaco ( Tivanisiran ) ya en Fase III para el Tratamiento de Ojo Seco Asociado a Dolor Ocular que podría alcanzar una Cuota de Mercado del 15 % Y otro en Fase II y tambien otra Filial en Genomica con una amplia cartera de productos ya en el Mercado y una implantación en varios Paises incluida China .
Los Fondos e inversores especializados en Biotecnología contratan y envian a las presentaciones y reuniónes a Oncológos , Cientificos ... por lo que a fecha de hoy ya todos saben que PharmaMar , a diferencia de otras Biotecnologicas Americanas , ya tiene un Farmaco Oncológico Aprobado y otros Tres en distintas Fases Clinicas ... aparte de toda la I+D Preclinica ... 1.600 Patentes ... 200.000 Muestras ... una Filial ( SYLENTIS ) Puntera en la Nueva tecnología de RNA con un Farmaco ( Tivanisiran ) ya en Fase III para el Tratamiento de Ojo Seco Asociado a Dolor Ocular que podría alcanzar una Cuota de Mercado del 15 % Y otro en Fase II y tambien otra Filial en Genomica con una amplia cartera de productos ya en el Mercado y una implantación en varios Paises incluida China .
Aparte de Dos Filiales Quimicas lideres en sus segmentos respectivos que desde siempre han aportado musculo Financiero a las Investigaciones en curso .

En 2017 los precios objetivos rondaban entre los 4,80 a los 6,75 euros ... destacando el precio objetivo de EDISON INVESTMENT que lo situaba en los 8,28 ( 1,84 Bn ) euros de los que 3 euros era el valor solo por Zepsyre .
Tambien hay que valorar y mucho el acuerdo alcanzado con Seattle Genetics lider Mundial en los Tratamientos con ADCs que son Medicamentos Dirigidos al Tratamiento del Cáncer diseñados para aprovechar la especificidad de los Anticuerpos y con la capacidad de liberar los Agentes Activos Directamente en las Células Cancerosas. ... lo cual Permitira Trabajar juntos ( PharmaMar y Seattle Genetics ) en el desarrollo de Tratamientos de Vanguardia .

Dichos Agentes son Muy Potentes Aportando Actividad Citotóxica Subnanomolar.
Pero llego el reves con Aplidin , un Fármaco activo y que mejoraba por poco lo que hay en el Mercado pero que la EMA y el CHMP se encargaron de ver sombras en la Metodología empleada ( una Metodología que si aceptaron en otros Farmacos ) y se aferraron al NO a su comercialización en Europa .
Esto suponía no ingresar 30 Millones en ventas ... pero el Mercado se encargo de descontar más de 300 Millones ... cosas del día a día en este Pais ..
Acto seguido se obtenían los Resultados con Zepsyre en Ovario que Igualaban a los que aporta el Mejor Tratamiento existente en el Mercado en 2ª linea y por tanto tambien se renunciaba a su presetación ante la EMA .
Pero en este caso hay Datos Positivos :
 *.- Zerpsyre " Ha Demostrado Ya " que Funciona y que tiene un Mejor Perfil de Seguridad y es Menos Toxico que el Topotecan ... algo ha tener muy en cuenta en el resto de Ensayos Clinicos con Zepsyre .
*.- Zerpsyre " Ha Demostrado Ya " que Funciona y que tiene un Mejor Perfil de Seguridad y es Menos Toxico que el Topotecan ... algo ha tener muy en cuenta en el resto de Ensayos Clinicos con Zepsyre .
*.- Recordar que el resultado en el ensayo de Ovario demuestra la actividad y que los datos aclaran que con un aumento de dosis se hubiera alcanzado el objetivo. *** Ese dato se corrigió en Pulmón con dosis diferentes *** .
*.- Otro Punto Positivo es que de Aprobarse en cualquier otra indicación ... Zepsyre se podría vender en EEUU via Off Label para Tratar Ovario .
*.- Otro Punto Positivo es que hay una Combinación Ginecologica ya terminando la Fase II de la que tendremos noticias esta misma semana ... se trata de la Combinación del PM01183 ( Zepsyre ) con OLAPARIB ( Lynparza ) de Astra Zeneca .
*.- En Cuanto a Pulmón tenemos ya Datos de la Supervivencia Global en pacientes de Fase Ib-II combinado con Doxo .
Son los datos publicados en el comunicado último.
10,2 MESES .
**.- La primera vez que se obtienen resultados de " Dos Dígitos" .
 *.- A todo ello se le suma la Decisión de la FDA de Pedir a PharmaMar que realice Ensayos Clinicos en Pediatria ... algo poco usual y que demuestra que Zepsyre es un Fármaco que aporta Confianza , Seguridad y Efectividad .
*.- A todo ello se le suma la Decisión de la FDA de Pedir a PharmaMar que realice Ensayos Clinicos en Pediatria ... algo poco usual y que demuestra que Zepsyre es un Fármaco que aporta Confianza , Seguridad y Efectividad .
Ahora es cuando direís mucho Bla Bla Bla como siempre y la cotización de PharmaMar se encuentra con un descuento descomunal con un precio equiparable a 1998 cuando todo lo aqui contado ni siquiera era factible en sueños .

Explicación : En España se continua Confundiendo Valor con Precio .
Algo sin pies ni cabeza ... No tiene ningún sentido el precio actual ... Tanto por Tecnico como por Fundamental la Compañía esta muy Infravalorada .
Pero ... :
 Una Salida al Mercado y tan Importante como es el de EEUU Acostumbra a Producirse tras Importantes Noticias - Avances ... y a tener muy en cuenta que en EEUU si saben valorar a una Biotecnologica ... y son muchas las Bios US que no tienen ningún Farmaco en el Mercado , estan Super Endeudas y sin embargo valen varias veces lo que vale PharmaMar en la actualidad ...
Una Salida al Mercado y tan Importante como es el de EEUU Acostumbra a Producirse tras Importantes Noticias - Avances ... y a tener muy en cuenta que en EEUU si saben valorar a una Biotecnologica ... y son muchas las Bios US que no tienen ningún Farmaco en el Mercado , estan Super Endeudas y sin embargo valen varias veces lo que vale PharmaMar en la actualidad ...
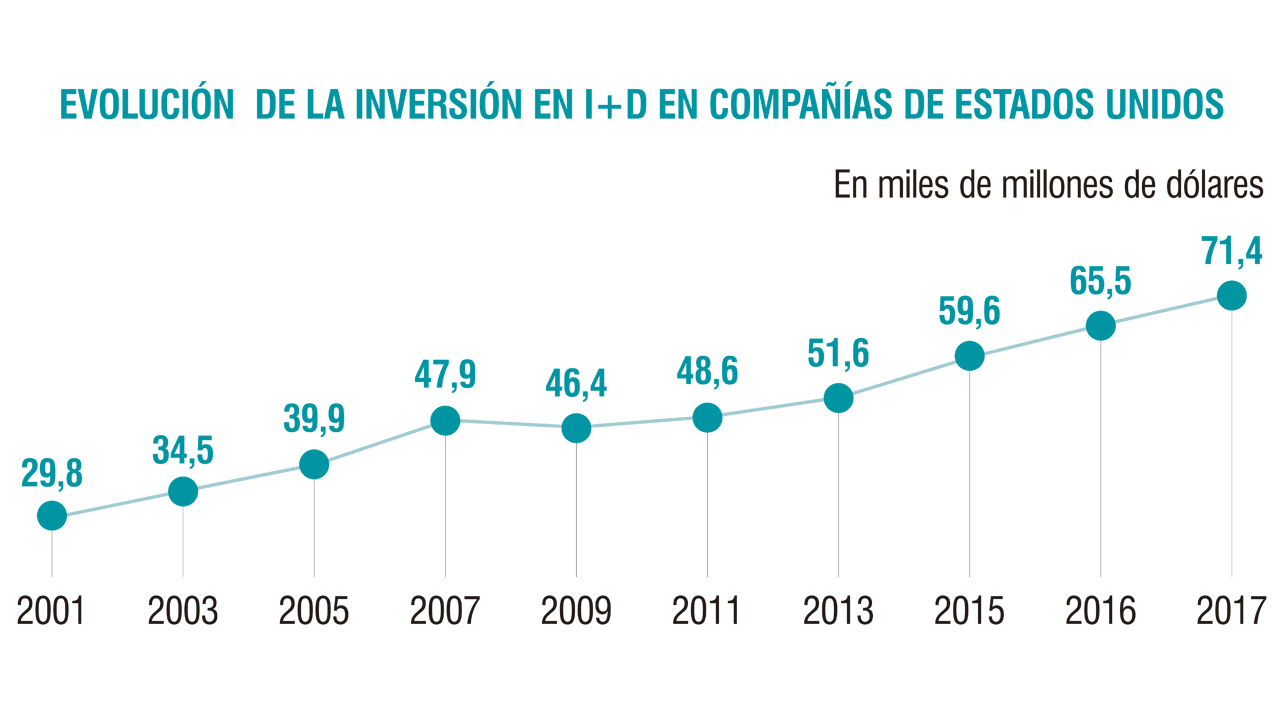
"En 2018 Superaremos los Niveles de Inversión en I+D alcanzados en 2016 y serán los más altos de la Historia". Además, por si fuera Poco Clara Su Apuesta Sousa-Faro Ha Apuntillado que Zepsyre “ Cambiará la Historia de Pharma Mar”.
¡¡¡ VEREMOS !!!! .
Pharma Jonpi , 13 Septiembre 2018 .

Una vez se Obtengan los Permisos Pertinentes Planteara una Ampliacion de Capital para dar Entrada a Fondos e Inversores Cualificados de EEUU .
Como siempre en estos casos, las salidas a bolsa en USA están lideradas por bancos americanos que evalúan previamente la empresa y el potencial. Y se trata de un proceso sometido a las normas de la SEC que implica no dar información que pudiera interferir en el proceso.
Es lo que llevan pidiendo los inversores US especializados desde tiempo ... Poder acceder a Pharmamar con $$$ ...

Ahora lo que Conviene son Resultados , Expectativas y Hechos Reales .
El Aumento de Capital No Debería de Suponer Ningún Problema ... Más Bien al Contrario .
PharmaMar lleva años preparando el Desembarco en EEUU .
PharmaMar está en Negociaciones con Dos Compañias del Sector con el Objetivo de Comenzar Nuevos Estudios en Combinación con Inmunoterapia.
 Los Fondos e inversores especializados en Biotecnología contratan y envian a las presentaciones y reuniónes a Oncológos , Cientificos ... por lo que a fecha de hoy ya todos saben que PharmaMar , a diferencia de otras Biotecnologicas Americanas , ya tiene un Farmaco Oncológico Aprobado y otros Tres en distintas Fases Clinicas ... aparte de toda la I+D Preclinica ... 1.600 Patentes ... 200.000 Muestras ... una Filial ( SYLENTIS ) Puntera en la Nueva tecnología de RNA con un Farmaco ( Tivanisiran ) ya en Fase III para el Tratamiento de Ojo Seco Asociado a Dolor Ocular que podría alcanzar una Cuota de Mercado del 15 % Y otro en Fase II y tambien otra Filial en Genomica con una amplia cartera de productos ya en el Mercado y una implantación en varios Paises incluida China .
Los Fondos e inversores especializados en Biotecnología contratan y envian a las presentaciones y reuniónes a Oncológos , Cientificos ... por lo que a fecha de hoy ya todos saben que PharmaMar , a diferencia de otras Biotecnologicas Americanas , ya tiene un Farmaco Oncológico Aprobado y otros Tres en distintas Fases Clinicas ... aparte de toda la I+D Preclinica ... 1.600 Patentes ... 200.000 Muestras ... una Filial ( SYLENTIS ) Puntera en la Nueva tecnología de RNA con un Farmaco ( Tivanisiran ) ya en Fase III para el Tratamiento de Ojo Seco Asociado a Dolor Ocular que podría alcanzar una Cuota de Mercado del 15 % Y otro en Fase II y tambien otra Filial en Genomica con una amplia cartera de productos ya en el Mercado y una implantación en varios Paises incluida China . Aparte de Dos Filiales Quimicas lideres en sus segmentos respectivos que desde siempre han aportado musculo Financiero a las Investigaciones en curso .

En 2017 los precios objetivos rondaban entre los 4,80 a los 6,75 euros ... destacando el precio objetivo de EDISON INVESTMENT que lo situaba en los 8,28 ( 1,84 Bn ) euros de los que 3 euros era el valor solo por Zepsyre .
Tambien hay que valorar y mucho el acuerdo alcanzado con Seattle Genetics lider Mundial en los Tratamientos con ADCs que son Medicamentos Dirigidos al Tratamiento del Cáncer diseñados para aprovechar la especificidad de los Anticuerpos y con la capacidad de liberar los Agentes Activos Directamente en las Células Cancerosas. ... lo cual Permitira Trabajar juntos ( PharmaMar y Seattle Genetics ) en el desarrollo de Tratamientos de Vanguardia .

Dichos Agentes son Muy Potentes Aportando Actividad Citotóxica Subnanomolar.
Pero llego el reves con Aplidin , un Fármaco activo y que mejoraba por poco lo que hay en el Mercado pero que la EMA y el CHMP se encargaron de ver sombras en la Metodología empleada ( una Metodología que si aceptaron en otros Farmacos ) y se aferraron al NO a su comercialización en Europa .
Esto suponía no ingresar 30 Millones en ventas ... pero el Mercado se encargo de descontar más de 300 Millones ... cosas del día a día en este Pais ..
Acto seguido se obtenían los Resultados con Zepsyre en Ovario que Igualaban a los que aporta el Mejor Tratamiento existente en el Mercado en 2ª linea y por tanto tambien se renunciaba a su presetación ante la EMA .
Pero en este caso hay Datos Positivos :
 *.- Zerpsyre " Ha Demostrado Ya " que Funciona y que tiene un Mejor Perfil de Seguridad y es Menos Toxico que el Topotecan ... algo ha tener muy en cuenta en el resto de Ensayos Clinicos con Zepsyre .
*.- Zerpsyre " Ha Demostrado Ya " que Funciona y que tiene un Mejor Perfil de Seguridad y es Menos Toxico que el Topotecan ... algo ha tener muy en cuenta en el resto de Ensayos Clinicos con Zepsyre .*.- Recordar que el resultado en el ensayo de Ovario demuestra la actividad y que los datos aclaran que con un aumento de dosis se hubiera alcanzado el objetivo. *** Ese dato se corrigió en Pulmón con dosis diferentes *** .
*.- Otro Punto Positivo es que de Aprobarse en cualquier otra indicación ... Zepsyre se podría vender en EEUU via Off Label para Tratar Ovario .
*.- Otro Punto Positivo es que hay una Combinación Ginecologica ya terminando la Fase II de la que tendremos noticias esta misma semana ... se trata de la Combinación del PM01183 ( Zepsyre ) con OLAPARIB ( Lynparza ) de Astra Zeneca .
*.- En Cuanto a Pulmón tenemos ya Datos de la Supervivencia Global en pacientes de Fase Ib-II combinado con Doxo .
Son los datos publicados en el comunicado último.
10,2 MESES .
**.- La primera vez que se obtienen resultados de " Dos Dígitos" .
 *.- A todo ello se le suma la Decisión de la FDA de Pedir a PharmaMar que realice Ensayos Clinicos en Pediatria ... algo poco usual y que demuestra que Zepsyre es un Fármaco que aporta Confianza , Seguridad y Efectividad .
*.- A todo ello se le suma la Decisión de la FDA de Pedir a PharmaMar que realice Ensayos Clinicos en Pediatria ... algo poco usual y que demuestra que Zepsyre es un Fármaco que aporta Confianza , Seguridad y Efectividad .Ahora es cuando direís mucho Bla Bla Bla como siempre y la cotización de PharmaMar se encuentra con un descuento descomunal con un precio equiparable a 1998 cuando todo lo aqui contado ni siquiera era factible en sueños .

Explicación : En España se continua Confundiendo Valor con Precio .
Algo sin pies ni cabeza ... No tiene ningún sentido el precio actual ... Tanto por Tecnico como por Fundamental la Compañía esta muy Infravalorada .
Pero ... :
 Una Salida al Mercado y tan Importante como es el de EEUU Acostumbra a Producirse tras Importantes Noticias - Avances ... y a tener muy en cuenta que en EEUU si saben valorar a una Biotecnologica ... y son muchas las Bios US que no tienen ningún Farmaco en el Mercado , estan Super Endeudas y sin embargo valen varias veces lo que vale PharmaMar en la actualidad ...
Una Salida al Mercado y tan Importante como es el de EEUU Acostumbra a Producirse tras Importantes Noticias - Avances ... y a tener muy en cuenta que en EEUU si saben valorar a una Biotecnologica ... y son muchas las Bios US que no tienen ningún Farmaco en el Mercado , estan Super Endeudas y sin embargo valen varias veces lo que vale PharmaMar en la actualidad ..."En 2018 Superaremos los Niveles de Inversión en I+D alcanzados en 2016 y serán los más altos de la Historia". Además, por si fuera Poco Clara Su Apuesta Sousa-Faro Ha Apuntillado que Zepsyre “ Cambiará la Historia de Pharma Mar”.
¡¡¡ VEREMOS !!!! .
Aumento "alarmante" de cáncer en el mundo .
El cáncer continúa progresando de forma "alarmante" en el mundo, con 18,1 millones de nuevos casos y 9,6 millones de decesos estimados en 2018, según los datos publicados por el Centro Internacional de Investigación sobre el Cáncer (IARC, por sus siglas en inglés), que depende de la OMS. ...
12 septiembre 2018
Luis Mora ( Director General de Pharmamar ) : PharmaMar está en Negociaciones con Dos Compañias del Sector con el Objetivo de Comenzar Nuevos Estudios en Combinación con Inmunoterapia.
ABC.es - Salud .

Hoy, el Cáncer de Pulmón Microcítico es el área de investigación prioritaria
para PharmaMar, un tipo de cáncer para el que no se ha aprobado ningún producto para segunda línea de tratamiento en
los últimos 20 años.
Según la American Cancer Society, alrededor del 15% de los Cánceres de pulmón son Cánceres de Pulmón Microcítico.
Se estima que, solo entre Estados Unidos y Europa, serán diagnosticados más de 630.000 personas con Cáncer de pulmón este año y provocará Otras 200.000 muertes en todo el mundo .
En esta indicación PharmaMar tiene dos ensayos clínicos en marcha con su molécula Zepsyre® (lurbinectedina), uno como agente único y otro en combinación con doxorrubicina.
Del primero, como agente único, PharmaMar ha presentado datos positivos durante el congreso de la Sociedad Americana de Oncología Clínica (ASCO), celebrado recientemente en Chicago. Se presentaron los datos de los primeros 61 pacientes analizados, de los 100 que abarca el ensayo, en los que se observó respuestas en un 39%, con una supervivencia global de 11,8 meses. Como referencia, Topotecan, el tratamiento actual en 2ª línea, ha mostrado en otros estudios una respuesta global del 24% y una supervivencia global de 5,8 meses.
Zepsyre® (lurbinectedina) también se encuentra en desarrollo clínico para el tratamiento de otros dos tipos de Tumores : Cáncer de Páncreas y el Sarcoma de Ewing, dos tipos de Cáncer que actualmente cuentan con pocas alternativas terapéuticas.
Además del Cáncer de Pulmón como área prioritaria, en PharmaMar estamos investigando para combatir el Cáncer Colorrectal. En septiembre tendremos datos de los primeros 30 pacientes tratados con otro de nuestros compuestos, PM184. Se trata deu n estudio en el que se administra PM184 como agente único en pacientes que hayan recibido hasta dos líneas previas para enfermedad avanzada. También con este fármaco está en marcha otro ensayo de fase I para el tratamiento de otros tumores sólidos en combinación con Gemcitabina.
En PharmaMar, adicionalmente, disponemos de una nueva área dedicada a la identificación y síntesis de moléculas de origen marino para su uso como agentes activos en Anticuerpos Conjugados.
Son moléculas estructuralmente variadas con novedosos mecanismos de acción que ofrecen la oportunidad de desarrollar anticuerpos conjugados de nueva generación. Ya se ha firmado un Acuerdo con Seattle Genetics Inc lider del sector .
...
Hoy, el Cáncer de Pulmón Microcítico es el área de investigación prioritaria
para PharmaMar, un tipo de cáncer para el que no se ha aprobado ningún producto para segunda línea de tratamiento en
los últimos 20 años.
Según la American Cancer Society, alrededor del 15% de los Cánceres de pulmón son Cánceres de Pulmón Microcítico.
Se estima que, solo entre Estados Unidos y Europa, serán diagnosticados más de 630.000 personas con Cáncer de pulmón este año y provocará Otras 200.000 muertes en todo el mundo .
En esta indicación PharmaMar tiene dos ensayos clínicos en marcha con su molécula Zepsyre® (lurbinectedina), uno como agente único y otro en combinación con doxorrubicina.
Del primero, como agente único, PharmaMar ha presentado datos positivos durante el congreso de la Sociedad Americana de Oncología Clínica (ASCO), celebrado recientemente en Chicago. Se presentaron los datos de los primeros 61 pacientes analizados, de los 100 que abarca el ensayo, en los que se observó respuestas en un 39%, con una supervivencia global de 11,8 meses. Como referencia, Topotecan, el tratamiento actual en 2ª línea, ha mostrado en otros estudios una respuesta global del 24% y una supervivencia global de 5,8 meses.
Zepsyre® (lurbinectedina) también se encuentra en desarrollo clínico para el tratamiento de otros dos tipos de Tumores : Cáncer de Páncreas y el Sarcoma de Ewing, dos tipos de Cáncer que actualmente cuentan con pocas alternativas terapéuticas.
Además del Cáncer de Pulmón como área prioritaria, en PharmaMar estamos investigando para combatir el Cáncer Colorrectal. En septiembre tendremos datos de los primeros 30 pacientes tratados con otro de nuestros compuestos, PM184. Se trata deu n estudio en el que se administra PM184 como agente único en pacientes que hayan recibido hasta dos líneas previas para enfermedad avanzada. También con este fármaco está en marcha otro ensayo de fase I para el tratamiento de otros tumores sólidos en combinación con Gemcitabina.
En PharmaMar, adicionalmente, disponemos de una nueva área dedicada a la identificación y síntesis de moléculas de origen marino para su uso como agentes activos en Anticuerpos Conjugados.
Son moléculas estructuralmente variadas con novedosos mecanismos de acción que ofrecen la oportunidad de desarrollar anticuerpos conjugados de nueva generación. Ya se ha firmado un Acuerdo con Seattle Genetics Inc lider del sector .
...
The Lancet publica los resultados obtenidos en Italia con la Combinación de Yondelis y Olaparib . Se planea el inicio de Dos Fases II ( Ovario y Sarcoma ) .
En relación ( Link ) : TOMAS: revisiting PARP inhibitor combination therapy .
Trabectedin and Olaparib in patients with advanced and non-resectable bone and soft-tissue sarcomas (TOMAS): an open-label, phase 1b study from the Italian Sarcoma Group .
Published : September 11, 2018 .
Giovanni Grignani, MD †
Lorenzo D'Ambrosio, MD †
Ymera Pignochino, PhD
Emanuela Palmerini, MD
Massimo Zucchetti, PhD
Paola Boccone, MD
Trabectedin is an alkylating drug with a unique mechanism of action causing single-strand and double-strand DNA breaks that activate DNA damage-response pathways. Based on our preclinical data, we hypothesised that poly(ADP-ribose) polymerase 1 (PARP1) inhibitors might be an ideal partner of trabectedin and aimed to assess the safety, identify the recommended phase 2 dose, and explore preliminary signs of activity of trabectedin and olaparib combination treatment in patients with bone and soft-tissue sarcoma.
Methods
We did an open-label, multicentre, phase 1b study, recruiting patients from the national Italian sarcoma network aged 18 years and older with histologically confirmed bone and soft-tissue sarcoma progressing after standard treatments with Eastern Cooperative Oncology Group performance status of 1 or less. In a classic 3 + 3 design, patients received a 24 h infusion of trabectedin on day 1 and olaparib orally twice a day in 21-day cycles across six dose levels (trabectedin 0·675–1·3 mg/m 2 every 3 weeks; olaparib 100–300 mg twice a day from day 1 to 21). Intermediate dose levels were permitted to improve safety and tolerability. The primary endpoint was determination of the recommended phase 2 dose (the maximum tolerated dose). Safety and antitumour activity were assessed in all patients who received at least one dose of the study drugs. We report the results of the dose-escalation and dose-expansion cohorts. The trial is still active but closed to enrolment, and follow-up for patients who completed treatment is ongoing. This trial is registered with ClinicalTrials.gov, number NCT02398058.
Findings
Between Nov 17, 2014, and Jan 30, 2017, of 54 patients assessed for eligibility, we enrolled 50 patients: 28 patients in the dose-escalation cohort and 22 patients in the dose-expansion cohort. Patients received a median of four cycles of treatment (IQR 2–6; range 1–17 [the patients who received the highest number of cycles are still on treatment]) with a median follow-up of 10 months (IQR 5–23). Considering all dose levels, the most common grade 3–4 adverse events were lymphopenia (32 [64%] of 50 patients), neutropenia (31 [62%]), thrombocytopenia (14 [28%]), anaemia (13 [26%]), hypophosphataemia (20 [40%]), and alanine aminotransferase concentration increase (9 [18%]). No treatment-related life-threatening adverse events or deaths occurred. One (2%) patient interrupted treatment without progression without reporting any specific toxicity. Observed dose-limiting toxicities were thrombocytopenia, neutropenia for more than 7 days, and febrile neutropenia. We selected intermediate dose level 4b (trabectedin 1·1 mg/m 2 every 3 weeks plus olaparib 150 mg twice a day) as the recommended phase 2 dose. Seven (14%; 95% CI 6–27) of 50 patients achieved a partial response according to Response Evaluation Criteria In Solid Tumors 1.1.
Interpretation
Trabectedin and olaparib in combination showed manageable toxicities at active dose levels for both drugs. Preliminary data on antitumour activity are encouraging. Two dedicated phase 2 studies are planned to assess activity of this combination in both ovarian cancer (EudraCT2018-000230-35) and soft-tissue sarcomas.
Funding
Italian Association for Cancer Research, Italian Sarcoma Group, Foundation for Research on Musculoskeletal and Rare Tumors, and Italian Ministry of Health.
Trabectedin and Olaparib in patients with advanced and non-resectable bone and soft-tissue sarcomas (TOMAS): an open-label, phase 1b study from the Italian Sarcoma Group .
Published : September 11, 2018 .
Giovanni Grignani, MD †
Lorenzo D'Ambrosio, MD †
Ymera Pignochino, PhD
Emanuela Palmerini, MD
Massimo Zucchetti, PhD
Paola Boccone, MD
Trabectedin is an alkylating drug with a unique mechanism of action causing single-strand and double-strand DNA breaks that activate DNA damage-response pathways. Based on our preclinical data, we hypothesised that poly(ADP-ribose) polymerase 1 (PARP1) inhibitors might be an ideal partner of trabectedin and aimed to assess the safety, identify the recommended phase 2 dose, and explore preliminary signs of activity of trabectedin and olaparib combination treatment in patients with bone and soft-tissue sarcoma.
Methods
We did an open-label, multicentre, phase 1b study, recruiting patients from the national Italian sarcoma network aged 18 years and older with histologically confirmed bone and soft-tissue sarcoma progressing after standard treatments with Eastern Cooperative Oncology Group performance status of 1 or less. In a classic 3 + 3 design, patients received a 24 h infusion of trabectedin on day 1 and olaparib orally twice a day in 21-day cycles across six dose levels (trabectedin 0·675–1·3 mg/m 2 every 3 weeks; olaparib 100–300 mg twice a day from day 1 to 21). Intermediate dose levels were permitted to improve safety and tolerability. The primary endpoint was determination of the recommended phase 2 dose (the maximum tolerated dose). Safety and antitumour activity were assessed in all patients who received at least one dose of the study drugs. We report the results of the dose-escalation and dose-expansion cohorts. The trial is still active but closed to enrolment, and follow-up for patients who completed treatment is ongoing. This trial is registered with ClinicalTrials.gov, number NCT02398058.
Findings
Between Nov 17, 2014, and Jan 30, 2017, of 54 patients assessed for eligibility, we enrolled 50 patients: 28 patients in the dose-escalation cohort and 22 patients in the dose-expansion cohort. Patients received a median of four cycles of treatment (IQR 2–6; range 1–17 [the patients who received the highest number of cycles are still on treatment]) with a median follow-up of 10 months (IQR 5–23). Considering all dose levels, the most common grade 3–4 adverse events were lymphopenia (32 [64%] of 50 patients), neutropenia (31 [62%]), thrombocytopenia (14 [28%]), anaemia (13 [26%]), hypophosphataemia (20 [40%]), and alanine aminotransferase concentration increase (9 [18%]). No treatment-related life-threatening adverse events or deaths occurred. One (2%) patient interrupted treatment without progression without reporting any specific toxicity. Observed dose-limiting toxicities were thrombocytopenia, neutropenia for more than 7 days, and febrile neutropenia. We selected intermediate dose level 4b (trabectedin 1·1 mg/m 2 every 3 weeks plus olaparib 150 mg twice a day) as the recommended phase 2 dose. Seven (14%; 95% CI 6–27) of 50 patients achieved a partial response according to Response Evaluation Criteria In Solid Tumors 1.1.
Interpretation
Trabectedin and olaparib in combination showed manageable toxicities at active dose levels for both drugs. Preliminary data on antitumour activity are encouraging. Two dedicated phase 2 studies are planned to assess activity of this combination in both ovarian cancer (EudraCT2018-000230-35) and soft-tissue sarcomas.
Funding
Italian Association for Cancer Research, Italian Sarcoma Group, Foundation for Research on Musculoskeletal and Rare Tumors, and Italian Ministry of Health.
11 septiembre 2018
Zepsyre en el WCLC 2018 . 19TH WORLD CONFERENCE ON LUNG CANCER. 23rd - 26th September, 2018. Metro Toronto Convention Centre . World Lung Preview – Small-Cell Showdown .
When the World Congress on Lung Cancer kicks off in Toronto later this month all eyes will be on Roche’s Impower-133 study.
The inroads that immuno-oncology has made into non-small cell lung cancer have highlighted how intractable the rarer small-cell disease still is. So limited has progress been that topotecan and amrubicin-containing chemo are still standards for treating SCLC.
This makes the unveiling of Roche’s Impower-133 study of Tecentriq the highlight of this month's World Lung conference. Unusually for an anti-PD-(L)1 study this first-line SCLC trial is known to have read out positively for progression-free as well as overall survival, and disclosure of the magnitude of the benefit will be keenly awaited.
The abstract is set to feature at the conference’s plenary session on September 25, and its content is embargoed until then. Doctors will also be keen to pick apart the full dataset for trends as to PD-L1 status and other biomarkers.
Featuring on Monday, and separately embargoed, is another Tecentriq study, Impower-132. This tests the Roche drug in first-line NSCLC in combination with Alimta, and thus is analogous to the Keynote-189 study of Keytruda, on the basis of which the Merck & Co drug secured full approval as a chemo combo in all non-squamous patients.
However, Impower-132 read out positively for PFS but not OS. Moreover, the US FDA has delayed by three months its review of Tecentriq’s first-line NSCLC filing, as part of an Avastin and chemo combo based on the Impower-150 trial, until December 5.
While a third setting, stage III, non-metastatic NSCLC, also features in the plenary courtesy of Astrazeneca’s Pacific study of Imfinzi, this could see less attention; since Imfinzi has already secured this use on its US label disclosure of the study’s numerical OS benefit will probably be the main point of interest .
Given that Imfinzi is the only immuno-oncology drug to have made progress in stage III disease the spotlight could fall on a rival study: an investigator-initiated trial of Keytruda in this setting is to be presented at World Lung on September 24. However, Merck has yet to reveal its path forward here.
Best of the rest
It would be unusual for immuno-oncology not to feature strongly at World Lung, and other data of interest involve mesothelioma, with trials of Keytruda as well as of Bristol-Myers Squibb’s rival, Opdivo.
Follow-on projects feature too, notwithstanding the fact that they are now coming very late to the party: Sanofi/Regeneron’s cemiplimab, already filed for cutaneous squamous cell carcinoma, features in a NSCLC abstract. And the failed second-line Javelin Lung 200 study of Merck KGaA/Pfizer’s Bavencio will be picked apart, though the real focus remains first-line use, where it is being evaluated in the Javelin Lung 100 trial.
It is not all about biologicals, of course.
Pharmamar’s Zepsyre is battling for a place in second-line SCLC, and keenly awaited data from a single-arm phase II trial will be used to handicap chances of success in its placebo-controlled phase III Atlantis study. This could also help drum up enthusiasm as Pharmamar seeks a US ADS listing.
The World Lung abstract features 27 subjects given the same Zepsyre plus chemo regimen used in phase III, and the company will make a strong case that the 7.9 months of OS reported in this trial so far bode well against historical data. Still, data cited at Asco put the benefit right in topotecan’s six to nine-month zone (Asco 2018 – Small cell lung data underwhelm but big readouts approach, June 5, 2018).
First-line checkpoint blockers like Tecentriq threaten to shake up the second-line market further. The Zepsyre abstract, like those of Opdivo, Bavencio and cemiplimab, is a placeholder with an early data cut, and up-to-date numbers will be released at World Lung itself.
The same goes for the presentation of Loxo’s LOXO-292, while Roche’s entrectinib paper is embargoed until September 24. The two assets, targeting Ret and Ros1 mutations respectively, form part of a resurgent targeted approach against specific genetically defined subtypes of NSCLC.
And what would a lung cancer conference be without a focus on combination therapy? A major session will take place on September 26 covering IO combos with IO, chemo, targeted agents and radiotherapy. The catastrophic failure of IDO inhibition has only slightly dampened enthusiasm, it seems.
10 septiembre 2018
Investigar medicamentos ya no es como antes .
Texto de Marta Ricart 09/09/2018 .
En los últimos tiempos, el plazo para crear un medicamento se ha alargado, el coste ha subido y, pese a los avances científicos, no se ha multiplicado la producción. De hecho, muchos médicos se quejan de la falta de tratamientos innovadores en sus especialidades. Guste o no, desarrollar nuevos fármacos y salvar vidas con ellas depende de algo tan prosaico como que las inversiones sean rentables y que los números cuadren.
Una enfermedad tan terrible y extendida como el alzheimer no tiene cura tres décadas después de que se empezara a tratar. Ni existe un medicamento que cronifique el deterioro cognitivo que causa. Los neurólogos se quejan de que disponen de un abanico de fármacos bastante limitado. De los más usados, el primero salió en 1984, otro en 1993, otro 10 años después… Hace varios años que no salen realmente nuevos.
...
En los últimos tiempos, el plazo para crear un medicamento se ha alargado, el coste ha subido y, pese a los avances científicos, no se ha multiplicado la producción. De hecho, muchos médicos se quejan de la falta de tratamientos innovadores en sus especialidades. Guste o no, desarrollar nuevos fármacos y salvar vidas con ellas depende de algo tan prosaico como que las inversiones sean rentables y que los números cuadren.
Una enfermedad tan terrible y extendida como el alzheimer no tiene cura tres décadas después de que se empezara a tratar. Ni existe un medicamento que cronifique el deterioro cognitivo que causa. Los neurólogos se quejan de que disponen de un abanico de fármacos bastante limitado. De los más usados, el primero salió en 1984, otro en 1993, otro 10 años después… Hace varios años que no salen realmente nuevos.
...
09 septiembre 2018
08 septiembre 2018
Novartis vende parte de su filial Sandoz en EEUU por 860 millones . Post by Celtia .
La farmacéutica suiza Novartis ha acordado vender parte del negocio de su filial Sandoz en EEUU a la india Aurobindo Pharma por 1.000 millones de dólares (859,7 millones de euros).
...
...
07 septiembre 2018
Pharma Mar materializará por fin sus planes de cotizar también en Estados Unidos .
P.J.: Es lo que llevan pidiendo los inversores US especializados desde tiempo ... Poder acceder a pharmamar con $$$ ... Ahora lo que conviene son resultados , expectativas y hechos reales y si encima acompañará Sandra ... El aumento de capital no debería de suponer ningún problema ... Más bien al contrario .
Zepsyre ( PM01183 ) . A las Expectativas en Tumores Sólidos ... Hay que añadir la Expectativa en Tumores Hematológicos . Leucemia Mieloide Aguda, Síndrome Mielodisplásico .
Lurbinectedin a Possible Option for Acute Myeloid Leukemia, Myelodysplastic Syndrome .
James Nam, PharmD // September 05, 2018.
Lurbinectedin may be a safe and effective treatment option for myelodysplastic syndrome (MDS) and acute myeloid leukemia (AML), according to a study published in Hematological Oncology.1
Previous preclinical in vitro and in vivo studies have demonstrated that lurbinectedin, a next-generation minor groove binder (MGB), has good antitumor activity in solid tumors; its efficacy in AML however, is unknown.
For this phase 1 dose-finding study, investigators enrolled 42 patients with relapsed/refractory AML or MDS. Patients were treated with 2 dosing schedules of lurbinectedin 1-hour IV infusions in a 3+3 design.
Of the 42 patients, 24 received 3.5 mg, 5 mg, 7 mg, or 6 mg on days 1 and 8. Overall, 3 patients experienced dose-limiting toxicities (DLT) including grade 4 rhabdomyolysis, grade 3 hyperbilirubinemia, and grade 3 oral herpes. Due to DLTs and an elevated dropout rate from early disease progression, the dose schedule was switched to 2 mg, 3 mg, 1 mg, or 1.5 mg for 3 consecutive days on days 1 to 3. No DLTs were observed at this schedule.
Other frequently observed adverse events (AEs) included gastrointestinal AEs, febrile neutropenia/infections, pulmonary AEs, and renal failure. Common laboratory abnormalities included increased creatinine, anemia, neutropenia, and thrombocytopenia.
Thirty-three of 42 (79%) patients had a decrease in blasts in the peripheral blood or bone marrow, and 1 and 2 patients achieved a partial response or a morphologic leukemia-free state, respectively. All participants discontinued treatment prior to study cutoff, primarily due to progressive disease (30 patients; 71%).
Patients with a chromosome 11q21-23 abnormality had significantly greater reductions in bone marrow blast compared with patients who did not.
The authors concluded that “while no sustained remissions were observed, single-agent lurbinectedin was transiently leukemia suppressive for some patients.”
James Nam, PharmD // September 05, 2018.
Lurbinectedin may be a safe and effective treatment option for myelodysplastic syndrome (MDS) and acute myeloid leukemia (AML), according to a study published in Hematological Oncology.1
Previous preclinical in vitro and in vivo studies have demonstrated that lurbinectedin, a next-generation minor groove binder (MGB), has good antitumor activity in solid tumors; its efficacy in AML however, is unknown.
For this phase 1 dose-finding study, investigators enrolled 42 patients with relapsed/refractory AML or MDS. Patients were treated with 2 dosing schedules of lurbinectedin 1-hour IV infusions in a 3+3 design.
Of the 42 patients, 24 received 3.5 mg, 5 mg, 7 mg, or 6 mg on days 1 and 8. Overall, 3 patients experienced dose-limiting toxicities (DLT) including grade 4 rhabdomyolysis, grade 3 hyperbilirubinemia, and grade 3 oral herpes. Due to DLTs and an elevated dropout rate from early disease progression, the dose schedule was switched to 2 mg, 3 mg, 1 mg, or 1.5 mg for 3 consecutive days on days 1 to 3. No DLTs were observed at this schedule.
Other frequently observed adverse events (AEs) included gastrointestinal AEs, febrile neutropenia/infections, pulmonary AEs, and renal failure. Common laboratory abnormalities included increased creatinine, anemia, neutropenia, and thrombocytopenia.
Thirty-three of 42 (79%) patients had a decrease in blasts in the peripheral blood or bone marrow, and 1 and 2 patients achieved a partial response or a morphologic leukemia-free state, respectively. All participants discontinued treatment prior to study cutoff, primarily due to progressive disease (30 patients; 71%).
Patients with a chromosome 11q21-23 abnormality had significantly greater reductions in bone marrow blast compared with patients who did not.
The authors concluded that “while no sustained remissions were observed, single-agent lurbinectedin was transiently leukemia suppressive for some patients.”
05 septiembre 2018
PM01183 ... A Look Back at FDA News in August 2018 .
In August 2018, the FDA approved several drugs and treatment regimens. There were also a number of breakthrough therapy designations granted this month, as well as a new orphan drug designation. One drug was granted a priority review, while several new drug applications (NDAs) and supplemental biologics license applications (sBLAs) were submitted.
...
Link : Lurbinectedin Granted Orphan Drug Designation from FDA for SCLC
An orphan drug designation was granted by the FDA for lurbinectedin. PharmaMar, the manufacturer of the drug, made the announcement on August 6. Data from a phase II multicenter basket trial support this treatment option for patients with SCLC.
...
El adiós de una presentadora de la BBC con cáncer: «El momento ha llegado. Me quedan solo días de vida» .
El lunes 3 de septiembre, Rachel publicó un emotivo mensaje que conmovió a sus seguidores. "En palabras de Frank Sinatra, me temo que ha llegado el momento, amigos. De repente me dijeron que solo tengo días. Es muy surrealista. Muchas gracias por todo el apoyo que he recibido", expresó la presentadora en sus redes sociales, revelando su actual estado. ...
Astellas anuncia la adquisición de Quethera . Una Compañía de Terapia Génica con sede en Reino Unido que se dedica a desarrollar Tratamientos Novedosos para Enfermedades Oculares, como el Glaucoma. .
MADRID 4 SEP, 2018.
Mediante esta operación, Astellas adquiere el programa de terapia génica oftálmica de Quethera, que utiliza un sistema de vectores virales adeno-asociados recombinantes (VAAr) para introducir genes terapéuticos en células retinianas diana para el tratamiento del glaucoma. El candidato preclínico principal del programa mejoró “significativamente” la supervivencia de las células ganglionares retinianas (CGR) en modelos preclínicos.
El presidente y CEO de esta entidad farmacéutica, Kenji Yasukawa, apunta que “el programa de VAAr puede ser una nueva opción terapéutica para el tratamiento del glaucoma refractario a través de un mecanismo independiente de la presión intraocular (PIO) y está dirigido a cubrir una necesidad médica importante para los pacientes con glaucoma que están en riesgo de perder la vista”.
Opciones terapéuticas
Por su parte, el CEO de Quethera, Peter Widdowson, resalta que “el novedoso enfoque tecnológico se centra en explorar posibles opciones terapéuticas para enfermedades oftálmicas comunes, como el glaucoma, que pueden causar ceguera y afectar gravemente a la calidad de vida de los pacientes”.
Según los términos del contrato de compra, Astellas podría pagar un máximo de 85 millones de libras en total, pago inicial y pagos dependientes de objetivos cumplidos, a los accionistas de Quethera para adquirir la misma. Una vez completada la compra, Quethera será una filial de propiedad absoluta de Astellas.
Mediante esta operación, Astellas adquiere el programa de terapia génica oftálmica de Quethera, que utiliza un sistema de vectores virales adeno-asociados recombinantes (VAAr) para introducir genes terapéuticos en células retinianas diana para el tratamiento del glaucoma. El candidato preclínico principal del programa mejoró “significativamente” la supervivencia de las células ganglionares retinianas (CGR) en modelos preclínicos.
El presidente y CEO de esta entidad farmacéutica, Kenji Yasukawa, apunta que “el programa de VAAr puede ser una nueva opción terapéutica para el tratamiento del glaucoma refractario a través de un mecanismo independiente de la presión intraocular (PIO) y está dirigido a cubrir una necesidad médica importante para los pacientes con glaucoma que están en riesgo de perder la vista”.
Opciones terapéuticas
Por su parte, el CEO de Quethera, Peter Widdowson, resalta que “el novedoso enfoque tecnológico se centra en explorar posibles opciones terapéuticas para enfermedades oftálmicas comunes, como el glaucoma, que pueden causar ceguera y afectar gravemente a la calidad de vida de los pacientes”.
Según los términos del contrato de compra, Astellas podría pagar un máximo de 85 millones de libras en total, pago inicial y pagos dependientes de objetivos cumplidos, a los accionistas de Quethera para adquirir la misma. Una vez completada la compra, Quethera será una filial de propiedad absoluta de Astellas.
04 septiembre 2018
J&J . Darzalex se adelanta con la aprobación de mieloma de primera línea en Europa .
La Nueva Aprobación hace que Darzalex sea el Primer Medicamento con Anticuerpos Aprobado en Primera Línea .
3rd September 2018
Johnson & Johnson’s Darzalex is to take a more central role in multiple myeloma treatment following its European approval in a new frontline combination.
Its pharma division Janssen has gained EU approval for its use alongside Takeda’s Velcade (bortezomib), melphalan and prednisone (VMP) for newly-diagnosed myeloma patients who are ineligible for high-dose chemotherapy and autologous stem cell transplant (ASCT), a key front-line treatment strategy.
The approval is based on the results of the ALCYONE clinical trial, which shows that adding Darzalex to VMP cuts the risk of disease progression or death by 50% in these patients.
The EU approval follows a nod from the FDA in May, and this frontline use will add extra impetus to the drug, which is already enjoying rapid growth. Sales nearly doubled in the second quarter compared to the same period last year, up to $511m in the second quarter ($298m in the US and $213m in the rest of the world).
First-line use will be the next growth driver for the intravenous anti-CD38 monoclonal antibody, initially based on the comparison with VMP, which showed the new drug reduced the risk of disease progression or death by 50%. The median progression free survival (PFS) for daratumumab-VMP had not yet been reached, compared to an estimated median PFS of 18.1 months for patients who received VMP alone. ...
Neumólogo advierte de que el 80% de los cáncer de pulmón se diagnostican en fase avanzada .
MADRID, 3 Sep. (EUROPA PRESS) -
El 80 por ciento de los cánceres de pulmón se diagnostican en fases avanzadas, a pesar de que la supervivencia global va aumentando y ya representa el 15 por ciento de todos los casos, según el miembro de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR), Francisco Javier Aspa.
Así lo ha puesto de manifiesto en su ponencia 'Cáncer de pulmón estadio I: decisiones diagnósticas y terapéuticas' durante el LI Congreso Nacional de SEPAR, donde el también jefe de sección de Neumología del Hospital Universitario La Princesa de Madrid ha señalado que, por el tipo de tejido que forma los tumores de pulmón, estos se dividen en cáncer de pulmón de células pequeñas (CPCP) y el cáncer de pulmón no de células pequeñas (NCPCP) que actualmente representa alrededor el 85 por ciento de los cánceres pulmonares y que engloba diversos tipos como el adenocarcinoma, fundamentalmente, además del carcinoma escamoso y el carcinoma de células grandes. ...
El 80 por ciento de los cánceres de pulmón se diagnostican en fases avanzadas, a pesar de que la supervivencia global va aumentando y ya representa el 15 por ciento de todos los casos, según el miembro de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR), Francisco Javier Aspa.
Así lo ha puesto de manifiesto en su ponencia 'Cáncer de pulmón estadio I: decisiones diagnósticas y terapéuticas' durante el LI Congreso Nacional de SEPAR, donde el también jefe de sección de Neumología del Hospital Universitario La Princesa de Madrid ha señalado que, por el tipo de tejido que forma los tumores de pulmón, estos se dividen en cáncer de pulmón de células pequeñas (CPCP) y el cáncer de pulmón no de células pequeñas (NCPCP) que actualmente representa alrededor el 85 por ciento de los cánceres pulmonares y que engloba diversos tipos como el adenocarcinoma, fundamentalmente, además del carcinoma escamoso y el carcinoma de células grandes. ...
Se reduce la tasa de recaía en el mieloma múltiple, un cáncer "incurable" pero cronificable, destaca un experto
MADRID, 3 Sep. (EUROPA PRESS) -
El mieloma múltiple es un tipo de cáncer hematológico que a día de hoy se considera crónico pero sigue siendo "incurable"; sin embargo, los nuevos fármacos han hecho que su tasa de recaída haya disminuido en los últimos años, según el jefe de servicio de Hematología del Hospital Universitario La Princesa, de Madrid, Adrián Alegre Amor.
En concreto, casi el 80-90 por ciento de los pacientes con este tipo de cáncer recaen, pero "hay un fracción de un 10 o 15 por ciento en la que se pude hablar de cronificación permanente; pero hay que estar muy atentos a las recaídas y seguir haciendo controles", ha insistido el doctor Alegre, en declaraciones a Europa Press.
...
El mieloma múltiple es un tipo de cáncer hematológico que a día de hoy se considera crónico pero sigue siendo "incurable"; sin embargo, los nuevos fármacos han hecho que su tasa de recaída haya disminuido en los últimos años, según el jefe de servicio de Hematología del Hospital Universitario La Princesa, de Madrid, Adrián Alegre Amor.
En concreto, casi el 80-90 por ciento de los pacientes con este tipo de cáncer recaen, pero "hay un fracción de un 10 o 15 por ciento en la que se pude hablar de cronificación permanente; pero hay que estar muy atentos a las recaídas y seguir haciendo controles", ha insistido el doctor Alegre, en declaraciones a Europa Press.
...
Novartis y Gilead ya negocian traer a España las primeras terapias génicas contra el cáncer . Post by Celtia .
Alberto Vigario /// 03/09/2018 .
Las multinacionales farmacéuticas Novartis y Gilead esperan poder traer a España a lo largo de este año las dos primeras terapias génicas contra el cáncer, un nuevo tipo de tratamiento personalizado que ha mostrado en ensayos una tasa de curación de hasta un 80% en varios tipos de tumores hematológicos, pero que asustan a los sistemas públicos de salud por su alto precio. ...
Las multinacionales farmacéuticas Novartis y Gilead esperan poder traer a España a lo largo de este año las dos primeras terapias génicas contra el cáncer, un nuevo tipo de tratamiento personalizado que ha mostrado en ensayos una tasa de curación de hasta un 80% en varios tipos de tumores hematológicos, pero que asustan a los sistemas públicos de salud por su alto precio. ...
02 septiembre 2018
Aplidin ( Plitidepsin ) : A Potential New Treatment for Relapsed/Refractory Multiple Muy .
Aplidin demostró actividad en Myeloma Multiple Recidivante / Refractario.
Leisch M, et al. Future Oncol. 2018.
Published Online : 16 Aug 2018 .
Abstract
Plitidepsin is a marine-derived anticancer compound isolated from the Mediterranean tunicate Applidium albicans.
It exerts pleiotropic effets on cancer cells, most likely by binding to the eukaryotic translation eEF1A2. This ultimately leads to cell-cycle arrest, growth inhibition and induction of apoptosis via multiple pathway alterations.
Recently, a Phase III randomized trial in patients with relapsed/refractory multiple myeloma reported outcomes for plitidepsin plus dexamethasone compared with dexamethasone.
Median progression-free survival was 3.8 months in the plitidepsin arm and 1.9 months in the dexamethasone arm (HR: 0.611; p = 0.0048). Here, we review preclinical data regarding plitidepsins mechanism of action, give an overview of clinical trial results across different tumor types as well as the latest results in multiple myeloma.
Leisch M, et al. Future Oncol. 2018.
Published Online : 16 Aug 2018 .
Abstract
Plitidepsin is a marine-derived anticancer compound isolated from the Mediterranean tunicate Applidium albicans.
It exerts pleiotropic effets on cancer cells, most likely by binding to the eukaryotic translation eEF1A2. This ultimately leads to cell-cycle arrest, growth inhibition and induction of apoptosis via multiple pathway alterations.
Recently, a Phase III randomized trial in patients with relapsed/refractory multiple myeloma reported outcomes for plitidepsin plus dexamethasone compared with dexamethasone.
Median progression-free survival was 3.8 months in the plitidepsin arm and 1.9 months in the dexamethasone arm (HR: 0.611; p = 0.0048). Here, we review preclinical data regarding plitidepsins mechanism of action, give an overview of clinical trial results across different tumor types as well as the latest results in multiple myeloma.
01 septiembre 2018
O xigante investidor propiedade de Sandra Ortega, Rosp Corunna, foi autorizado pola CNMV para elevar do 5 ao 10 por cento a súa participación na firma, a antiga Zeltia, agora PharmaMar.
Por arredor de 20 millóns de euros reforzará así a súa presenza na que fora unha das grandes apostas investidoras de súa nai, Rosalía Mera.
BioSpain 2018 // ASEBIO .
La Biotecnología tendrá un ‘Color’ Especial .
Sevilla acoge del 25 al 27 de septiembre una nueva edición —la novena— de este foro biotecnológico celebrado con periodicidad bienal y que se revela como el marco perfecto para el intercambio de conocimiento, ideas y experiencias entre todos los actores del sector biotecnológico, que se ha convertido en la gran plataforma de proyección internacional de la biotecnología española.
BioSpain atrajo en su última edición de Bilbao (2016) a 1.750 delegados de 800 empresas de 29 países, 233 expositores, 50 inversores internacionales, 49 conferencias y se mantuvieron 3.000 reuniones en el partnering.
El programa de este año da un peso destacado al área biomédica.
Sevilla acoge del 25 al 27 de septiembre una nueva edición —la novena— de este foro biotecnológico celebrado con periodicidad bienal y que se revela como el marco perfecto para el intercambio de conocimiento, ideas y experiencias entre todos los actores del sector biotecnológico, que se ha convertido en la gran plataforma de proyección internacional de la biotecnología española.
BioSpain atrajo en su última edición de Bilbao (2016) a 1.750 delegados de 800 empresas de 29 países, 233 expositores, 50 inversores internacionales, 49 conferencias y se mantuvieron 3.000 reuniones en el partnering.
El programa de este año da un peso destacado al área biomédica.
31 agosto 2018
Zepsyre ( Lurbinectedin / PM01183 ) Leucemia . Resultados en pacientes con Leucemia obtenidos por : The University of Texas MD Anderson Cancer Center, Department of Leukemia, Houston, TX, USA.
Safety and Tolerability of Lurbinectedin (PM01183) in Patients with Acute Myeloid Leukemia and Myelodysplastic Syndrome.
Benton, Christopher B; Chien, Kelly S; Tefferi, Ayalew; Rodriguez, Jose; Ravandi, Farhad; Daver, Naval; Jabbour, Elias; Jain, Nitin; Alvarado, Yesid; Kwari, Monica; Pierce, Sherry; Maiti, Abhishek; Hornbaker, Marisa; Santos, Margarida A; Martinez, Sara; Siguero, Mariano; Zblewski, Darci; Al-Kali, Aref; Hogan, William J; Kantarjian, Hagop; Pardanani, Animesh; Garcia-Manero, Guillermo.
Hematological Oncology : 2018-08-28.
The University of Texas MD Anderson Cancer Center, Department of Leukemia, Houston, TX, USA.
Trabectedin is an FDA-approved DNA minor groove binder (MGB) that has activity against translocation-associated sarcomas. Lurbinectedin is a next-generation MGB with pre-clinical activity against myeloid leukemia cells.
A dose-finding phase 1 clinical trial was performed in patients with acute myeloid leukemia (AML) and myelodysplastic syndrome (MDS) with further assessment of safety and tolerability.
Forty-two patients with relapsed/refractory AML/MDS received lurbinectedin administered as a 1-hour intravenous infusion in a 3+3 study design.
Two dosing schedules were used: 3.5 mg, 5 mg, 7 mg, or 6 mg on days 1 and 8 or 2 mg, 3 mg, 1 mg, or 1.5 mg for 3 consecutive days on days 1 to 3. Three patients experienced dose-limiting toxicities (DLTs) of rhabdomyolysis (grade 4), hyperbilirubinemia (grade 3), and oral herpes (grade 3) with the days 1 and 8 schedule.
Otherwise, adverse events (AEs) mainly consisted of gastrointestinal manifestations (n=11), febrile neutropenia/infections (n=4), pulmonary toxicity (n=2), and renal failure (n=2). The most common laboratory abnormalities observed were an increase in creatinine (93%) and anemia, neutropenia, and thrombocytopenia (100%).
Overall, 33 of 42 patients (79%) had reduction in blasts in peripheral blood or bone marrow. One patient achieved a partial response and two patients a morphologic leukemia-free state. Most (n=30, 71%) were discontinued due to progressive disease. Early deaths occurred from disease-related causes that were not attributable to lurbinectedin. Four patients with a chromosome 11q21-23 abnormality had significantly greater bone marrow blast reduction than those without such abnormality, with decrease of 31±14% (n=4) vs. 8±8% (n=16), respectively (P=0.04).
Overall, lurbinectedin was safe and tolerated using the schedules and dose levels tested.
While no sustained remissions were observed, single-agent lurbinectedin was transiently leukemia suppressive for some patients.
Benton, Christopher B; Chien, Kelly S; Tefferi, Ayalew; Rodriguez, Jose; Ravandi, Farhad; Daver, Naval; Jabbour, Elias; Jain, Nitin; Alvarado, Yesid; Kwari, Monica; Pierce, Sherry; Maiti, Abhishek; Hornbaker, Marisa; Santos, Margarida A; Martinez, Sara; Siguero, Mariano; Zblewski, Darci; Al-Kali, Aref; Hogan, William J; Kantarjian, Hagop; Pardanani, Animesh; Garcia-Manero, Guillermo.
Hematological Oncology : 2018-08-28.
The University of Texas MD Anderson Cancer Center, Department of Leukemia, Houston, TX, USA.
Trabectedin is an FDA-approved DNA minor groove binder (MGB) that has activity against translocation-associated sarcomas. Lurbinectedin is a next-generation MGB with pre-clinical activity against myeloid leukemia cells.
A dose-finding phase 1 clinical trial was performed in patients with acute myeloid leukemia (AML) and myelodysplastic syndrome (MDS) with further assessment of safety and tolerability.
Forty-two patients with relapsed/refractory AML/MDS received lurbinectedin administered as a 1-hour intravenous infusion in a 3+3 study design.
Two dosing schedules were used: 3.5 mg, 5 mg, 7 mg, or 6 mg on days 1 and 8 or 2 mg, 3 mg, 1 mg, or 1.5 mg for 3 consecutive days on days 1 to 3. Three patients experienced dose-limiting toxicities (DLTs) of rhabdomyolysis (grade 4), hyperbilirubinemia (grade 3), and oral herpes (grade 3) with the days 1 and 8 schedule.
Otherwise, adverse events (AEs) mainly consisted of gastrointestinal manifestations (n=11), febrile neutropenia/infections (n=4), pulmonary toxicity (n=2), and renal failure (n=2). The most common laboratory abnormalities observed were an increase in creatinine (93%) and anemia, neutropenia, and thrombocytopenia (100%).
Overall, 33 of 42 patients (79%) had reduction in blasts in peripheral blood or bone marrow. One patient achieved a partial response and two patients a morphologic leukemia-free state. Most (n=30, 71%) were discontinued due to progressive disease. Early deaths occurred from disease-related causes that were not attributable to lurbinectedin. Four patients with a chromosome 11q21-23 abnormality had significantly greater bone marrow blast reduction than those without such abnormality, with decrease of 31±14% (n=4) vs. 8±8% (n=16), respectively (P=0.04).
Overall, lurbinectedin was safe and tolerated using the schedules and dose levels tested.
While no sustained remissions were observed, single-agent lurbinectedin was transiently leukemia suppressive for some patients.
Sandra Ortega consigue ‘luz verde’ para doblar su apuesta por PharmaMar .

Rosp Corunna, el gigante inversor propiedad de Sandra Ortega, ha solicitado a la Comisión Nacional del Mercado de Valores (CNMV) una autorización para elevar su participación en PharmaMar del actual 5% al 10%, tal y como avanzó OKDIARIOesta misma semana. Según fuentes próximas a la hija del fundador de Inditex, el organismo regulador de los mercados ya ha dado ‘luz verde’, con lo que las compras podrían estar produciéndose en estos mismos instantes.
Trabectedin for soft-tissue sarcoma safe, effective in elderly patients .
This subgroup analysis of the elderly population of ET743-SAR-3007 suggests that elderly patients with soft tissue sarcoma and good performance status can expect clinical benefit from trabectedin similar to that observed in younger patients. ...
30 agosto 2018
Sandra Ortega pide autorización a la CNMV para comprar un 5% más de PharmaMar y alcanzar el 10% .
P.J.: Por el momento tan solo está publicación da por hecho este Hito ... Por lo tanto haría falta una confirmación más ... Digamos Oficial ...
Borja Jiménez , 30/08/2018 // 6:57.
Rosp Corunna, el gigante inversor propiedad de Sandra Ortega, ha solicitado a la Comisión Nacional del Mercado de Valores (CNMV) una autorización para elevar su participación en PharmaMar del actual 5% al 10%, según han señalado a OKDIARIO fuentes próximas a la hija del fundador de Inditex, Amancio Ortega.
La sociedad, que entró en el capital de la antigua Zeltia (PharmaMar) en el año 2002, ha pedido permiso a la CNMV para que le autorice a comprar, por algo menos de 20 millones de euros, un 5% más del capital de la firma farmacéutica.
Cabe recordar, en este sentido, que el grupo farmacéutico fue una de las grandes apuestas inversoras de Rosalía Mera, la primera esposa del fundador de Inditex Amancio Ortega. Sin embargo, una vez falleció en 2013, el imperio se quedó en manos de su hija mayor, que se ha visto obligada a pedir un permiso a la CNMV porque, al formar parte del Consejo de Administración de la compañía, no puede comprar así como así. Un permiso que, por cierto, ya fue denegado hace apenas unas semanas por el organismo regulador que preside Sebastián Albella.
La farmacéutica cotiza en el entorno de los 1,65 euros por título, mientras que el consenso de mercado le otorga un potencial alcista superior al 30%, hasta los 2,37 euros por acción. Y es que, en lo que llevamos de año, los títulos de PharmaMar retroceden más de un 30%, lo que ha dejado las acciones a muy buen precio a ojos de Sandra Ortega, que quiere aprovechar el desplome para hacerse el doble de fuerte en la empresa.
Borja Jiménez , 30/08/2018 // 6:57.
Rosp Corunna, el gigante inversor propiedad de Sandra Ortega, ha solicitado a la Comisión Nacional del Mercado de Valores (CNMV) una autorización para elevar su participación en PharmaMar del actual 5% al 10%, según han señalado a OKDIARIO fuentes próximas a la hija del fundador de Inditex, Amancio Ortega.
La sociedad, que entró en el capital de la antigua Zeltia (PharmaMar) en el año 2002, ha pedido permiso a la CNMV para que le autorice a comprar, por algo menos de 20 millones de euros, un 5% más del capital de la firma farmacéutica.
Cabe recordar, en este sentido, que el grupo farmacéutico fue una de las grandes apuestas inversoras de Rosalía Mera, la primera esposa del fundador de Inditex Amancio Ortega. Sin embargo, una vez falleció en 2013, el imperio se quedó en manos de su hija mayor, que se ha visto obligada a pedir un permiso a la CNMV porque, al formar parte del Consejo de Administración de la compañía, no puede comprar así como así. Un permiso que, por cierto, ya fue denegado hace apenas unas semanas por el organismo regulador que preside Sebastián Albella.
La farmacéutica cotiza en el entorno de los 1,65 euros por título, mientras que el consenso de mercado le otorga un potencial alcista superior al 30%, hasta los 2,37 euros por acción. Y es que, en lo que llevamos de año, los títulos de PharmaMar retroceden más de un 30%, lo que ha dejado las acciones a muy buen precio a ojos de Sandra Ortega, que quiere aprovechar el desplome para hacerse el doble de fuerte en la empresa.
29 agosto 2018
Investigadores españoles descubren una nueva función de una proteína que abre la puerta a fármacos contra el cáncer de mama .
Un trabajo liderado por el doctor Josep Villanueva, investigador principal del Grupo de Biomarcadores Tumorales del Vall d'HebronInstituto de Oncología (VHIO), ha descubierto una función alternativa extracelular de la proteína HMGA1 relacionada con la invasión tumoral. Según detallan los responsables del estudio, este hallazgo abre la puerta a fármacos específicos para el cáncer de mama triple negativo. ...
27 agosto 2018
SYL136001v10 ( Sylentis ) Un Compuesto para tratar Enfermedades de la Retina, como la Degeneración Macular relacionada con la edad y la Retinopatía Diabética, que se administrará mediante " Gotas Oftálmicas en lugar de Inyecciones Intraoculares ". Podría iniciar ya el Ensayo con Humanos este mismo año .
La Firma Española Sylentis ( PharmaMar Grupo ) ha desarrollado un compuesto para tratar enfermedades de la retina, como la degeneración macular relacionada con la edad y la retinopatía diabética, que se administrará mediante gotas oftálmicas en lugar de inyecciones intraoculares.
El fármaco ( SYL136001v10 ) , que se ha probado en animales, es un pequeño ARN interferente capaz de penetrar en las células de la retina y bloquear la formación de nuevos vasos sanguíneos.
"Su efectividad ha sido probada en modelos animales y los ensayos con humanos comenzarán a fines de 2018", explicó Covadonga Pañeda, Gerente de Investigación y Desarrollo de Sylentis.
Pañeda ha explicado que este compuesto, 'es un pequeño ARN interferente (siRNA) diseñado para silenciar la expresión de NRARP, una proteína que controla la formación de nuevos vasos sanguíneos en la retina'.
Ella dijo: "El fármaco ejerce su acción al entrar en las células de la retina, donde impide la síntesis de esta proteína y bloquea la formación de nuevos vasos, que es una de las características fundamentales de las enfermedades degenerativas de la retina".
Los Compuestos usados actualmente para tratar estas Enfermedades se basan en Anticuerpos grandes que no pueden penetrar desde la superficie Ocular a la Retina, por lo que deben administrarse mediante Inyecciones Intravítreas.
 Añadió: "Los pacientes que sufren de degeneración macular relacionada con la edad o retinopatía diabética deben ir al hospital donde los Tratamientos se realizan con Inyecciones Oculares, lo cual es molesto y doloroso, y también implica una inversión financiera significativa para el sistema de salud".
Añadió: "Los pacientes que sufren de degeneración macular relacionada con la edad o retinopatía diabética deben ir al hospital donde los Tratamientos se realizan con Inyecciones Oculares, lo cual es molesto y doloroso, y también implica una inversión financiera significativa para el sistema de salud".Sin embargo, señaló, 'SiRNA, como SYL136001v10, son hasta 10 veces más pequeños que estos tratamientos. Su tamaño les permite penetrar en la retina e inhibir la formación de nuevos vasos sanguíneos después de su aplicación en gotas oftálmicas, como hemos demostrado en modelos animales.
«Los estudios de eficacia han demostrado que la reducción de NRARP en la retina mediante ARNip conduce a la regresión de las lesiones angiogénicas retinianas y que las reducciones observadas son equivalentes a las de anti-VEGF, que es el tratamiento estándar actual para estas enfermedades con ocular inyecciones.
Suscribirse a:
Entradas (Atom)