Jazz Pharmaceuticals Announces First Patient Enrolled in EMERGE-201 Phase 2 Basket Trial Evaluating Zepzelca® (lurbinectedin) Monotherapy in Patients with Sel ect Advanced or Metastatic Solid Tumors .
************************
Lurbinectedin US . PharmaMar Para Poder Conseguir la Aprobación Completa en EEUU Para el Tratamiento de Segunda Línea del Cáncer de Pulmón Microcítico ... Debe Llevar a Cabo , Como Sponsor , Otra Fase III Para Intentar Batir al Topotecán ( Con el Ensayo Atlantis No lo Consiguió ) . Esta Ya a Punto de Iniciar el Reclutamiento ... Y Esta Previsto Que Termine en Mayo 2025 .
Lurbinectedin Necesita Si o Si la " Aprobación Completa " ( Full Aproval ) en EEUU Para el Tratamiento de Pacientes de Segunda Línea con Cáncer de Pulmón de Células Pequeñas .
Por lo Que " PHARMAMAR " está a Punto de Iniciar Ya el Reclutamiento de Dicha Nueva Fase III ... Previsto en Principio Para Enero 2022 y Que ha Fecha de Hoy Aún No se ha Iniciado ... Y Que Concluirá en MAYO 2025 .
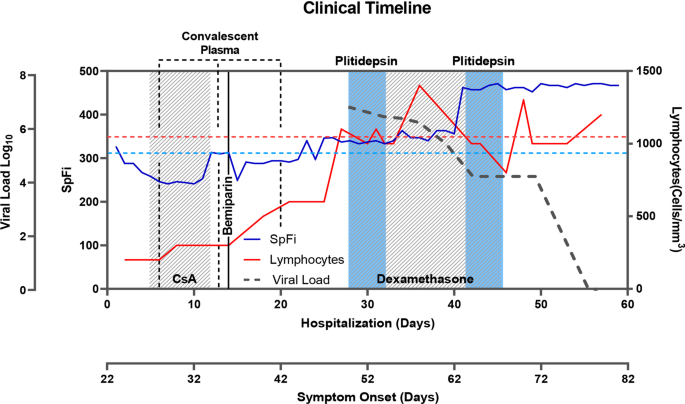
El Ensayo Clínico de Fase III Atlantis Que Llevó a Cabo PharmaMar y Que Tenía Que Servir Para la Obtención de la Full Aproval en EEUU Para el Tratamiento de Cáncer de Pulmón Microcítico y También Para la Aprobación en Europa ... Terminó en Fiasco ... " No Superó al Topotecán ".
**.- Por ello " PHARMAMAR " Tiene Que Volver a Realizar Otra Fase III en el Intento de Superar al Topotecán de una Vez ... Y Conseguir Por Fin la Full Aproval en EEUU y el Ok en Europa .
**.- Se Trata del Ensayo Clínico Confirmatorio de Fase III, Lagoon, Que Evalúa Lurbinectedina Para el Tratamiento de Pacientes con Cáncer de Pulmón Microcítico Recurrente.
" SI ÉL RESULTADO ES POSITIVO " :
LAGOON Servirá Como Ensayo Confirmatorio de Lurbinectedin Para Asegurar la Aprobación Completa en EE.UU. De Igual Forma, se Utilizará como ensayo de registro ante la Agencia Europea de Medicamentos (EMA, European Medicines Agency) Para Obtener la Autorización de Comercialización en Europa .
¿"" PERO Y SI EL RESULTADO DE FASE III LAGOON NO ES POSITIVO ""? :
... Mejor No Contemplar esta Opción ...
***************************************



























.jpeg)