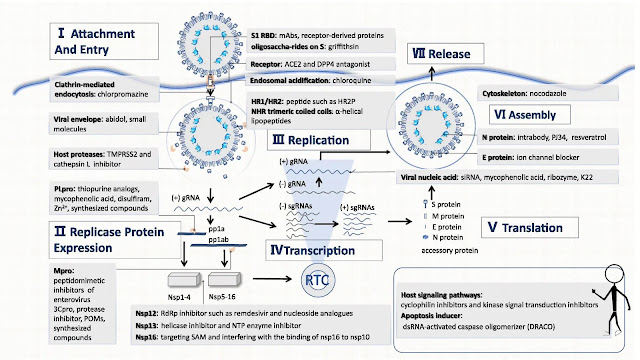
JAZZ PHARMACEUTICALS SOBRE LOS RIESGOS E INCERTIDUMBRES CON LURBINECTEDIN ( ZEPZELCA ) ... : PREVEMOS QUE LURBINECTEDIN ( ZEPZELCA ) COMPITA CON PRODUCTOS GENÉRICOS EN EL FUTURO .
16 marzo 2021
AstraZeneca Suministrará al Gobierno de EE. UU. 500.000 Dosis Adicionales de su Anticuerpo AZD7442 COVID-19 .
... Es una Combinación de Anticuerpos de Acción Prolongada Que Podría Ayudar a Prevenir y Tratar COVID-19 .
AstraZeneca también tiene un acuerdo separado para suministrar al Departamento de Defensa 100.000 dosis, lo que significa que el suministro potencial de AZD7442 en EE. UU. Se ha elevado a 700.000 en 2021.
"La combinación de anticuerpos de acción prolongada tiene el potencial de ofrecer protección casi inmediata a quienes no pueden vacunarse, tanto para prevenir la infección como para tratar la enfermedad en pacientes que ya están infectados con el virus", dijo Pascal Soriot, director ejecutivo de ARIZONA.
“El apoyo del gobierno de Estados Unidos es fundamental para ayudar a acelerar el desarrollo de AZD7442, que creemos será una herramienta importante en la lucha contra COVID-19”, agregó.
AZD7442 se basa en anticuerpos aislados de dos pacientes que se habían recuperado del COVID-19 por investigadores del Centro Médico de la Universidad de Vanderbilt en los EE. UU. ...
Rusia está "en la Primera Fase de las Negociaciones Para el Posible Lanzamiento de la Vacuna SputnikV en Varios Países Europeos, Incluidos Alemania y Francia" .
El 8 de marzo pasado se informó de que la farmacéutica italo-suiza Adienne Pharma & Biotech y el Fondo de Inversión Directa Ruso (FIDR), que tiene la patente del preparado, habían firmado un acuerdo para producir Sputnik V en Italia.
Es el "primer acuerdo para la producción de la vacuna Sputnik en Italia y el primero de este tipo en Europa", informó entonces la Cámara de Comercio Ítalo-Rusa (CCIR).
El presidente del fondo soberano ruso, Kiril Dmítriev, aseguró el lunes que el FIDR "ya ha alcanzado acuerdos con empresas de Italia, España, Francia y Alemania para lanzar la producción de la Sputnik V". ...
Nuevos Resultados de la Fase III . Tratamiento con Bamlanivimab y el Etesevimab de Lilly Juntos Redujeron las Hospitalizaciones y la Muerte en un 87% en el Ensayo de Fase III Para el COVID19 Inicial .
- Los Nuevos Datos Muestran Que la Terapia Redujo el Riesgo de Hospitalizaciones y Muertes en un 87% .
- Segunda Lectura Positiva del Ensayo de Fase III Para Bamlanivimab y Etesevimab Juntos .
- Resultados Apoyan el Uso de Bamlanivimab 700 mg y Etesevimab 1400 mg, la Dosis Autorizada en Estados Unidos y Varios Países del Mundo .
- A Través del Trabajo de Lilly con la Fundación Bill & Melinda Gates, Lilly Está Proporcionando Dosis de Bamlanivimab de Forma Gratuita en Ruanda y Marruecos .
Canadá 15 Marzo 2021 .
Esta Nueva Cohorte de Fase 3 de BLAZE-1 incluyó a 769 pacientes de alto riesgo, de 12 años o más, con COVID-19 leve a moderado (terapia: n = 511; placebo: n = 258). Hubo cuatro eventos en pacientes que tomaron Bamlanivimab con Etesevimab y 15 eventos en pacientes que tomaron placebo, lo que representa una reducción del riesgo del 87% (p <0,0001). Bamlanivimab y Etesevimab juntos también demostraron mejoras estadísticamente significativas en criterios de valoración secundarios clave. Estos resultados son consistentes con los observados en otros conjuntos de datos de BLAZE-1: en la cohorte de fase 3 anterior, bamlanivimab 2800 mg con etesevimab 2800 mg redujo el riesgo de hospitalizaciones y muertes en un 70% y en la cohorte de fase 2, Bamlanivimab solo redujo el riesgo de hospitalizaciones y visitas a urgencias en aproximadamente un 70 por ciento.En esta nueva cohorte de Fase 3, hubo cuatro muertes en total, todas las cuales se consideraron relacionadas con COVID-19 y todas ocurrieron en pacientes que tomaron placebo; no se produjeron muertes en pacientes que recibieron tratamiento con Bamlanivimab y Etesevimab juntos. En las dos cohortes de Fase 3 del estudio que se han analizado hasta la fecha, no ha habido muertes en pacientes que recibieron tratamiento con Bamlanivimab y Etesevimab juntos, y 14 muertes en pacientes que recibieron placebo, 13 de las cuales se consideraron relacionadas con COVID-19. En este conjunto de datos, el perfil de seguridad de Bamlanivimab y Etesevimab juntos fue consistente con las observaciones de otros ensayos de Fase 1, Fase 2 y Fase 3 que evaluaron estos anticuerpos.
"Estos resultados positivos refuerzan nuestros hallazgos anteriores y respaldan la dosis [autorizada por la FDA] de Bamlanivimab 700 mg con Etesevimab 1400 mg. Estos datos convincentes, además de la reciente EUA de la FDA, la decisión del CHMP de la EMA y la recomendación para el tratamiento en las Pautas de tratamiento del COVID-19 de los Institutos Nacionales de la Salud: brinde a los proveedores de atención médica información adicional sobre el uso de Bamlanivimab y Etesevimab juntos como un tratamiento que potencialmente puede salvar vidas para ayudar a las personas con mayor riesgo de complicaciones graves del COVID-19 ", dijo Daniel Skovronsky, MD, Ph.D., director científico de Lilly y presidente de Lilly Research Laboratories. "Los resultados consistentes observados en múltiples cohortes de este ensayo durante varios meses, incluso cuando han surgido nuevas cepas de COVID-19, indican que Bamlanivimab con Etesevimab mantiene sus efectos contra una variedad de variantes, particularmente las que circulan en los EE. UU."
Lilly continúa colaborando con los reguladores globales para que Bamlanivimab solo y Bamlanivimab y Etesevimab juntos estén disponibles en todo el mundo. Bamlanivimab solo y Bamlanivimab con Etesevimab juntos están autorizados bajo vías especiales / de emergencia, en el contexto de la pandemia, en los EE. UU. Y la Unión Europea. Además, el Bamlanivimab solo está autorizado para uso de emergencia en Canadá , Panamá , Kuwait , los Emiratos Árabes Unidos, Israel , Ruanda , Marruecos y muchos otros países. A través del trabajo de Lilly con la Fundación Bill & Melinda Gates, Lilly está proporcionando dosis de Bamlanivimab de forma gratuita en Ruanda y Marruecos .
COVID19 . Cómo Se Podría Usar el Plasma de Convalecencia Para Tratar Nuevas Variantes del Coronavirus, Especialmente Donde las Vacunas son Escasas .
El aumento de las variantes contagiosas del coronavirus ha generado temores de que puedan evadir tanto las vacunas existentes como los tratamientos autorizados como los anticuerpos monoclonales.
El expresidente Donald Trump recibió un lote experimental de anticuerpos monoclonales de la compañía farmacéutica Regeneron en octubre pasado, atribuyéndole su recuperación. La Administración de Alimentos y Medicamentos emitió una autorización de uso de emergencia poco después.
Pero dicho tratamiento estaba dirigido al virus original, lo que llevó a muchos expertos a temer que los tratamientos existentes también pudieran resultar menos efectivos frente a nuevas variantes.
El Dr. Arturo Casadevall, presidente del departamento de microbiología molecular e inmunología de la Facultad de Salud Pública Bloomberg de Johns Hopkins, es menos sombrío. Incluso si las vacunas finalmente resultan menos efectivas contra las variantes, dijo a Insider, aún puede haber una manera de ayudar a los pacientes infectados con estas cepas, tanto en los EE. UU. Como en el mundo en desarrollo.
El plasma de convalecencia, donado por personas que se han recuperado del virus y luego inyectado en personas con infecciones activas, proporciona anticuerpos generados por el sistema inmunológico del donante. Es una estrategia que se ha utilizado durante décadas, incluso se utilizó hace un siglo en la pandemia de gripe de 1918, y en agosto de 2020 fue autorizada para uso de emergencia por la Administración de Alimentos y Medicamentos para tratar el COVID-19.
El plasma convaleciente es similar al anticuerpo monoclonal terapias , que son medicamentos desarrollados en laboratorio que siguen el mismo enfoque y ofrecen una infusión de proteínas diseñadas para reconocer y atacar una amenaza particular. Pero a diferencia de sus primos manufacturados, los nuevos lotes de plasma no requieren una revisión regulatoria potencialmente prolongada antes de que puedan utilizarse.
"Una cosa sobre el plasma convaleciente es que no necesita desarrollo", dijo Casadevall. "Si vas a hacer una vacuna, tienes que desarrollarla. Si quieres producir anticuerpos monoclonales, tienes que desarrollarla. Con el plasma convaleciente, todo lo que necesitas son pacientes que se recuperen y tengas una terapia".
En los próximos meses, predice Casadevall, los pacientes que se hayan recuperado de diversas variantes de coronavirus habrán donado suficiente plasma convaleciente que (en teoría) un paciente debería poder ir a un hospital y recibir un tratamiento adaptado a la variante que les afecta.