JAZZ PHARMACEUTICALS SOBRE LOS RIESGOS E INCERTIDUMBRES CON LURBINECTEDIN ( ZEPZELCA ) ... : PREVEMOS QUE LURBINECTEDIN ( ZEPZELCA ) COMPITA CON PRODUCTOS GENÉRICOS EN EL FUTURO .
31 octubre 2022
Krogan And Company Desde el Inicio del la Pandemia se Han Centrado en Mapear Cientos de Proteínas y su Apuesta se Centró en 69 Compuestos ... 20 de Ellos Ya Están en Ensayos Clínicos y en Concreto Plitidepsina Fue la Más Efectiva en el Tratamiento con Ratones Infectados Con las Variantes Relevantes . PharmaMar Ya Tiene el Compuesto en Ensayo Clínico de Fase III en el Intento de Conseguir los Mismos Resultados en Humanos . ... ¿ Pero y Si el Virus Se Espabila y Encuentra Otra Proteína No Bloqueada Para Poder Acceder A Nuestro Organismo y Reproducirse ... ?
Covid Uses Our Proteins Against Us .
A New Strategy Seeks To Block That .
Scientists Are Exploring Treatments That Would Remain Effective Regardless Of How The Virus Evolves .
Al Principio de la Pandemia, Krogan y un grupo de colaboradores internacionales Mapearon cientos de Proteínas Humanas y las Proteínas Virales que dependen de ellas, y elaboraron una lista de 69 Compuestos con el potencial de interrumpir esas Interacciones. Casi 20 han Entrado en Ensayos Clínicos contra la Covid-19.
LA CARA :
Krogan está especialmente interesado en uno, la Plitidepsina, que proviene de una especie de chorro de mar que se encuentra solo en las Aguas de la Isla Española de Ibiza .
Dijo que el Medicamento ha sido efectivo en el Tratamiento de Ratones Infectados con Cada una de las Principales Variantes de Coronavirus .
La Farmacéutica Española PharmaMar ha puesto en marcha un Ensayo Clínico de Fase III de Plitidepsina, que también se está explorando como posible Tratamiento Contra el Cáncer. ...
***************************
****************
********
LA CRUZ :
Craig Wilen Va Más Allá ... : Lo Malo Será Que el Virus Encuentre Otra Manera Entrar en el Cuerpo Humano ... Sin Pasar por la Proteína eEF1a Que es la Que Bloquea Aplidin entonces ...
Degeneración Macular / FDA . Outlook Therapeutics Alentado Por la Aceptación de la FDA de la Solicitud de Lytenava ( Bevacizumab ) Para Tratar la Enfermedad Ocular de la Retina . De Aprobarse Recibiría 12 Años de Exclusividad Regulatoria en los EE. UU. .
La FDA Estableció una Fecha Objetivo de la Ley de Tarifas para Usuarios de Medicamentos Recetados (PDUFA) del 29 de Agosto de 2023.
Si se Aprueba, Outlook Therapeutics Dijo Que se Espera Que su Medicamento Etiquetado Como ONS-5010, Nombre Comercial Lytenava, Reciba 12 años de Exclusividad Regulatoria en los EE. UU. ...
Akeso Announces Oral Presentation of IVONESCIMAB (PD-1/VEGF Bi-Specific) in First-line Treatment of ES-SCLC on ACLC 2022 . En Combinación con QUIMIOTERAPIA Demostró Superioridad Tanto en Eficacia Antitumoral Como en la Supervivencia .
ETOPÓSIDO + PLATINO Ha Sido el Stándar de Atención Para el Tratamiento de Primera Línea de ES-SCLC por Más de 30 Años .
Se Aprobaron Dos Inhibidores de PD-L1 en Combinación con Quimioterapia Para tratar ES-SCLC, Pero el Beneficio de Supervivencia Para los Pacientes Sigue Siendo Muy Limitado .
Los Resultados Prometedores Presentados por AKESO en el Congreso ACLC 2022 ... Están Demostrando Que IVONESCIMAB Combinado con ETOPÓSIDO+CARBOPLATIN Superan Tanto en Eficacia Antitumoral Como en Seguridad ... A los Comparantes Disponibles en el Mercado .
Los Datos Preliminares de la Combinación de AK112 con ETOPÓSIDO y CARBOPLATIN Mostraron un Perfil de Seguridad Favorable y una eficacia Antitumoral Prometedora Como Tratamiento de Primera Línea en Pacientes con ES-SCLC Y PUEDE SER UNA OPCIÓN DE TRATAMIENTO PROMETEDORA .
En Comparación con los Datos de los Inhibidores de PD-L1 Comercializados en Combinación con QUIMIOTERAPIA, AK112 en Combinación con QUIMIOTERAPIA Demostró una Eficacia Antitumoral Superior y un Beneficio de Supervivencia .
Al 1 de junio de 2022 , Todos los Pacientes habían Recibido al Menos una Dosis de AK112 .
La Mediana de Tiempo de Seguimiento fue de 7,2 Meses .
- La Mediana de Supervivencia libre de Progresión (SLP) fue de 6,9 meses, con una Tasa de SLP a los 6 meses del 52,1 % .
- La Tasa de Remisión Objetiva (ORR) fue del 87,5 % y la Tasa de Control de la Enfermedad (DCR) fue del 96,9 % .
- Los Datos de Supervivencia Global (SG) No están Maduros .
- No se Observó Ninguna Nueva Señal de Seguridad . ...
30 octubre 2022
29 octubre 2022
ESCLEROSIS LATERAL . Buscan 75 VOLUNTARIOS Para un Esperanzador Tratamiento Pionero .
La investigación se basa en el uso de las propias células del paciente extraídas de la médula ósea y está liderada por el Instituto de Neurociencias (IN), centro mixto del CSIC y la Universidad Miguel Hernández (UMH) de Elche, junto a los hospitales públicos Virgen de la Arrixaca de Murcia, Doctor Balmis de Alicante y Sant Joan d'Alacant, con financiación del Instituto de Salud Carlos III de Madrid y también donaciones particulares . ...
A la EMA No le Tiembla el Pulso y Retira los Medicamentos con ANFEPRAMONA Para la Obesidad del Mercado ... al Determinar Que los Riesgos Superan los Beneficios del Tratamiento .
El Comité para la Evaluación de Riesgos en Farmacovigilancia ( PRAC, por sus siglas en inglés ) de la Agencia Europea del Medicamento ( EMA, por sus siglas en inglés ) Ha Confirmado su Recomendación de Retirar las Autorizaciones de Comercialización de los Medicamentos Para la OBESIDAD con ANFEPRAMONA , Tras Observar Riesgo de Problemas Cardíacos y Psiquiátricos . ...
28 octubre 2022
La Vacuna de AstraZeneca Aumentó el Riesgo de Trombos un 30% Más Que la de Pfizer .
Un estudio publicado en «The BMJ» arroja más luz sobre el riesgo de desarrollar un tipo de trombos sanguíneos relacionados con la vacunas del Covid-19. Se trata del estudio más amplio que ha analizado la asociación entre las vacunas de adenovirus, Janssen y AstraZeneca, y las de ARNm, como la Pfizer-BioNTech, y el riesgo de trombosis con síndrome de trombocitopenia (TTS) y más de 10 millones de personas vacunadas.
Además, se observó una tendencia hacia un mayor riesgo de trombosis venosa con trombocitopenia después de una primera dosis de vacuna de Ad26.COV2.S, que necesita replicarse en otros lugares. ...
PharmaMar Actualiza su I+D . Destaca Que en China Ya Ha Finalizado el Reclutamiento en la Fase I con Zepzelca SCLC . Con APLIDIN Se Realizará una Fase II en España con Pacientes InmunoDeprimidos Hospitalizados Con COVID19 .
Se Echa en Falta el Cuarto Fármaco de PharmaMar PLOCABULIN ( PM184 ) ... y También la de Bamosiran (SYL040012) Para el Tratamiento de Glaucoma de SYLENTIS .
1.- Segmento de Oncología: Pharma Mar. Evolución de los Compuestos :
A) Trabectedina (YONDELIS)
Sarcoma de Tejidos Blandos
Al finalizar el tercer trimestre de 2022, se encuentran bajo gestión 20 estudios post-autorización, de los que 6 continúan en fase de inclusión de nuevos pacientes. El resto de estudios se encuentran en fase de cierre y análisis de datos, o pendientes de pres entación de resultados. Adicionalmente, un estudio se encuentra actualmente en fase de activación.
En el congreso de la Sociedad Europea de Oncología Médica (ESMO) celebrado en París del 9 al 13 de septiembre, se presentaron los resultados finales del estudio YONSAR, estudio no intervencional, que evalúa la eficacia y seguridad de Yondelis® en la práctica de vida Real en Alemania.
Ovario
En esta indicación se gestionan actualmente 9 estudios, con 4 de ellos manteniendo reclutamiento activo.
B) Lurbinectedina (ZEPZELCA )
El 5 de agosto, lurbinectedina recibió la Designación de Medicamento Innovador (Innovation Passport) de la Agencia Reguladora de Medicamentos y Productos Sanitarios de Reino Unido (MHRA, por sus siglas en inglés). Este es el primer paso para la concesión de La vía de acceso y licencia innovadora (ILAP, Innovative Licensing and Access Pathway) de la MHRA, cuyo objetivo es acelerar el tiempo de comercialización, facilitando el acceso de los pacientes a los medicamentos. Los criterios para esta designación incluyen los casos en los que la enfermedad pone en peligro la vida o es gravemente debilitante, o en los que existe una necesidad significativa de los pacientes o de la salud pública y en los que el medicamento tiene el potencial de ofrecer beneficios a los pacientes (mejora de la efic acia o la seguridad, mejora de la atención al paciente o de la calidad de vida en comparación con otras opciones terapéuticas) .
En el mes de septiembre, Boryung Corporation socio de Pharma Mar para determinados territorios asiáticos, recibió la aprobación condicional para comercialización de Zepzelca® (lurbinectedina) por parte del Ministerio de Seguridad Alimentaria y Farmacéutica (MFDS, Ministry of Food and Drug Safety) de Corea del Sur para el tratamiento de pacientes adultos con cáncer de pulmón micro cítico metastásico con progresión de la enfermedad en o después de quimioterapia basada en platino. Esta nueva aprobación de Lurbinectedina se basa en los datos clínicos del ensayo con monoterapia, abierto, multicéntrico y de un solo brazo realizado en 105 pacientes adultos con cáncer de pulmón microcítico metastásico recurrent e (incluidos pacientes con enfermedad sensible a platino y Resistente a platino), que la Administración de Alimentos y Medicamentos (FDA, por sus siglas en inglés) utilizó para conceder la aprobación acelerada de lurbinectedina en los Estados Unidos .
Cáncer de Pulmón Microcítico
El estudio de fase III confirmatorio en cáncer de pulmón microcítico recurrente en segunda línea (estudio LAGOON) acordado con la FDA inició el reclutamiento de pacientes durante el tercer trimestre de 2022. Se trata de un ensayo de tres brazos en el que se comparará Lurbinectedina como monoterapia o en combinación con irinotecán, frente a la elección de los investigadores de irinotecán o tpotecan .
Si el estudio es positivo, este ensayo podría servir para confirmar el beneficio de lurbinectedina en el tratamiento del cánc er de pulmón microcítico cuando los pacientes progresan tras el tratamiento de primera línea con un régimen basado en plat ino en Estados Unidos,y servir de ensayo de registro en otros territorios fuera de Estados Unidos .
Continua de manera satisfactoria el reclutamiento del estudio de nuestro socio Jazz Pharmaceuticals de fase II I (IMforte) que evalúa Zepzelca en combinación con un inhibidor de PD-L1 en cáncer de pulmón de células pequeñas. Este estudio patrocinado por Roche y Coofinanciado por Jazz, medirá la supervivencia libre de progresión y los beneficios generales de supervivencia de Zepzelca y atezolizumab administrados en combinación en comparación con atezolizumab como agente único. Esta investigación colaborativa proporcionará información sobre una opción terapéutica potencialmente nueva para el cáncer de pulmón de células pequeñas en el entorno de primera Línea de tratamiento .
También continua el estudio de recogida de datos retrospectivo en Francia en el que se incluyen pacientes que han recibido Lurbinectedina como parte del programa "Autorisation d’acces compassionnel” (autorización de uso nominativo/compasivo) para describir las características clínicas y demográficas de estos pacientes evaluando supervivencia global, supervivencia libre de progresión en vida real, etc. Este estudio está liderado por los grupos nacionales Intergroupe Francophone de Cancerologie Thoracique y el Groupe Français de Pneumo-Cancérologie siendo el investigador principal el Profesor Nicolas Girard del Institut Curie (Paris) .
Estudios de Zepzelca (lurbinectedina) en combinación
Durante todo este periodo, ha continuado el reclutamiento en los estudios de fase I en combinación con irinotecan, pembrolizumab y atezolizumab según el plan previsto .
En concreto, el estudio de combinación con irinotecan avanza en el proceso de expansión en cáncer de pulmón microcítico, sarcoma sinovial y tumores neuroendocrinos según el plan previsto .
Estudio de Fase I en China
Este Estudio se está Realizando Por Nuestro Socio Luye y ha Sido Diseñado Para Conocer la Dosis de Zepzelca en Pacientes Chinos .
El Reclutamiento de Pacientes ha Finalizado y Actualmente se Encuentra en Fase de Seguimiento .
C) Ecubectedina (PM14)
El primer ensayo clínico de fase I/II de ecubectedina ha alcanzado la dosis óptima para la administración en pacientes con tumores sólidos avanzados. Actualmente se encuentra reclutando en fase II de expansión en un ensayo Basket donde se tratan diferentes tipos tumorales .
Estudios en Combinación
El estudio de fase I/II de este compuesto en combinación con irinotecan continúa reclutando pacientes de manera satisfactoria. Del mismo modo, el estudio de fase Ib en combinación con atezolizumab continua de manera satisfactoria el reclutamiento de pacientes .
D) Virología: Plitidepsina
El estudio NEPTUNO de fase III, multicéntrico, aleatorizado y controlado para determinar la eficacia y seguridad de dos niveles de dosis de plitidepsina diferentes frente al control en pacientes adultos que requieren hospitalización para el tratamiento de la infección moderada por COVID 19, continua con el reclutamiento en Europa y Latino América .
Adicionalmente, en los últimos días de septiembre, se ha presentado a las autoridades regulatorias en España (AEMPS y Comité Ético) el estudio clínico NEREIDA de fase II, multicéntrico, abierto, aleatorizado, controlado, en canasta y pragmático para determinar la eficacia y seguridad de la plitidepsina en comparación con el control en pacientes adultos inmunodeprimidos con COVID -19 sintomática que necesitan asistencia hospitalaria .
Extensión del estudio APLICOV-PC Fase II
Ha finalizado el estudio de extensión en una cohorte de pacientes adultos con infección por SARS -CoV-2, que requirieron ingreso hospitalario y recibieron tratamiento con plitidepsina en el estudio APLICOV-PC, con el fin de evaluar la frecuencia de la morbilidad post-COVID-19 y caracterizar el perfil de las secuelas en los pacientes que participaron en el estudio APLICOV-PC .
2.- Segmento de RNA de Interferencia : Sylentis
Durante este periodo de 2022 se ha continuado con el ensayo clínico de fase III de tivanisirán para el tratamiento de la enfermedad de ojo seco asociada al Síndrome de Sjögren, en él se reclutarán 200 pacientes. Se han incrementado el número de centros de 31 a 35 hospitales en Estados Unidos. Los objetivos primario y secundario del mismo son, respectivamente, evaluar la eficacia (signos y síntomas) y la seguridad de tivanisirán .
En el mes de marzo se inició el reclutamiento del primer paciente en Estados Unidos en un nuevo e nsayo de fase III para evaluar la seguridad a largo plazo de tivanisirán para el tratamiento de los signos y síntomas de la enfermedad de ojo seco. Se trata de un estudio multicéntrico y aleatorizado en el que se reclutarán aproximadamente 300 pacientes con enfermedad de ojo seco de leve a severo. A finales de septiembre el reclutamiento de pacientes avanzaba a buen ritmo. El objetivo primario del ensayo es evaluar la seguridad de tivanisirán administrado en ambos ojos una vez al día durante 1 año en forma de gotas oftálmicas. Además, se evaluarán los parámetros de eficacia (signos y síntomas) de estos pacientes. El diseño del estudio de seguridad a largo plazo ha sido autorizado por la FDA y formará parte de la solicitud de registro para comercialización .
Respecto al compuesto SYL1801, se ha completa do el primer estudio de fase I, para el tratamiento y/o prevención de la Neovascularización coroidea, causa común de enfermedades de la retina como pueden ser la Degeneración Macular Asociada a la Edad (DMAE) o la retinopatía diabética . El ensayo se ha llevado a cabo en 36 voluntarios sanos en el Hospital Ramón y Cajal de Madrid con dos intervalos de tratamiento: dosis única ascendente y dosis múltiple ascendente durante siete días consecutivos de tratamiento. Los resultados finales indican que todas las dosis administradas del SYL1801 en forma de solución oftálmica, fueron seguras y bien toleradas en los voluntarios sanos. En este tercer trimestre se ha presentado la documentación regulatoria a la agencia reguladora para el inicio de la fase II de ensayo clínico .
PharmaMar Reduce su Beneficio un 20,7% y se Sitúa en los 43,3 Millones en los Nueve Primeros Meses ( 54,7 Millones en 2021 ) . Los Ingresos Totales Han Sido de 141,4 Millones de euros ( 140,3 Millones en 2021 ) .
PharmaMar Ha Informado de unas Ganancias de 43,3 millones, Frente a los 54,7 del Año Anterior ... El Beneficio Cae un 20,7% Debido a la Inversión en I+D .
En Cuanto a los Ingresos Totales, éstos Han Sido de 141,4 millones de euros, Frente a los 140,3 millones Registrados en el Mismo Periodo del Ejercicio Anterior .
Del Total de ingresos, los ingresos recurrentes (ventas más royalties), han aumentado un 3% hasta los 119,3 millones de euros durante los primeros nueve meses del año. De estos ingresos, las ventas de Yondelis (trabectedina) han crecido un 6% en sus ventas brutas hasta el 30 de septiembre. "La presión en precios se traslada a la venta neta que, pese a dicha presión, registra un aumento de cerca del 1% hasta los 52,2 millones de euros", ha indicado la entidad en un comunicado .
Los ingresos no recurrentes de PharmaMar, aquellos procedentes de los acuerdos de licencia, han registrado un total de 22,1 millones de euros durante los nueve primeros meses del año (24,4 millones a septiembre 2021). "Estos ingresos corresponden a la imputación a ingresos de las cantidades recibidas en 2020 como consecuencia del acuerdo de licencia de lurbinectedina con Jazz Pharmaceuticals (300 millones de dólares), cantidades que se van imputando en la cuenta de resultados en función del grado de avance de los compromisos contractuales", según se ha señalado .
La inversión del Grupo PharmaMar en I+D hasta el 30 de septiembre de 2022 se ha incrementado en un 23%, hasta los 57,1 millones de euros. Del total de la partida destinada a I+D, el área de oncología es la que ha registrado la mayor inversión con un total 48,4 millones de euros frente a los 40,1 millones invertidos en el mismo periodo del año anterior .
Asimismo, se ha disminuido la deuda total durante este periodo en 5,8 millones de euros hasta los 39,8 millones, "que vuelve a marcar un nuevo mínimo en la deuda de los últimos 20 años". De esta forma, la caja neta ha registrado un total de 201,2 millones, que representa un crecimiento del 20% desde el inicio del presente ejercicio .
PharmaMar ha apuntado que el pasado 27 de septiembre el Consejo de Administración decidió cesar la actividad en el área de diagnóstico, que se desarrollaba a través de su filial participada al 100%, Genomica. "Si bien el cese de esta actividad contribuirá a mejorar el margen de explotación del Grupo PharmaMar en próximos ejercicios, a 30 de septiembre de 2022 el proceso de cese ha tenido un impacto en cuenta de resultados de 4,6 millones de euros, resultado de adicionar a las pérdidas propias de la actividad de diagnóstico en este periodo, las provisiones necesarias por los gastos de cierre", ha detallado la empresa .
27 octubre 2022
PharmaMar Retrasa Hasta Finales de 2023 el Ensayo de Aplidin Para el Covid19 Por la Menor Incidencia de la Pandemia . Ahora No Hay Picos y Por lo Tanto No Hay Pacientes”, Explicaron Fuentes de la Cotizada . Post By Finanzas.com .
Los Motivos Que Esgrime PharmaMar Para el Retraso .
A Mediados de abril, la compañía dio un nuevo impulso al ensayo de Aplidin al acercarse al pleno de hospitales donde recluta voluntarios.
El problema es que la pandemia tiene sus propios tiempos, que no marca la compañía, lo que ha obligado a Pharmamar a mover ficha.
“Son actualizaciones que hacemos continuamente, no es la primera sobre Neptuno en cuanto a plazos. El último plazo que habíamos dado era finales de este año y se ha actualizado a finales del año que viene”, confirmaron a finanzas.com en fuentes de la compañía .
La decisión de Pharmamar supuso un nuevo revés para un medicamento que la compañía sacó de su cartera de oncología, para concentrar sus esfuerzos en el desarrollo como antiviral .
“Seguimos con el reclutamiento al ritmo que va la pandemia en los diferentes países. Ahora no hay picos y por lo tanto no hay pacientes”, explicaron fuentes de la cotizada .
Lo cierto es que el estudio no solo se tiene que adecuar al ritmo de la pandemia sino al perfil de los pacientes y a cómo van cambiando las variantes .
Decepción Entre los Analistas
Lo retos a los que se enfrenta el ensayo Neptuno, supeditado a la evolución de la pandemia, no pasaron desapercibidos para las firmas de análisis que siguen a Pharmamar.
De hecho, el broker más alcista con el grupo gallego, la firma londinense Rx Securities, ya comenzó a replegar velas en su valoración hace unos meses, precisamente por los riesgos asociados a aplidin, tal y como avanzó finanzas.com . ...
Carboplatin Should Be Favored Over Cisplatin For Small Cell Lung Cancer Treatment Due to Toxicity Profile .
El CARBOPLATIN Debe Preferirse al CISPLATIN Para el Tratamiento del Cáncer de Pulmón de Células Pequeñas Debido al Perfil de Toxicidad .
COVID19 . Éxito del Tratamiento con NANGIBOTIDE en Pacientes Hospitalizados Muy Graves . El Estudio de INOTREM Para el Tratamiento de Pacientes Críticos Alcanza los Puntos Finales .
Inotrem Ha Anunciado los Resultados Positivos de ESSENTIAL, su Ensayo Clínico de Fase II en Pacientes con COVID-19 HOSPITALIZADOS en Unidades de Cuidados Intensivos y con Dificultad Respiratoria Aguda .
Resultados del Estudio
El Estudio ESSENTIAL finalizó en 220 Pacientes Aleatorizados de la UCI que requerían Soporte Ventilatorio (estadio 5 o 6 en una escala ordinal de estado clínico de 7 puntos) y comparó la infusión de NANGIBOTIDE a 1 mg/kg/h durante hasta 5 días de tratamiento con el tratamiento estándar . A pesar de un tamaño de muestra inferior al previsto, el estudio cumplió con su criterio de valoración principal de una mejora en el estado clínico de acuerdo con la escala ordinal de estado clínico de 7 puntos desde el inicio hasta el día 28.
El tratamiento con NANGIBOTIDE también mostró una reducción estadística y clínicamente significativa del 12 % absoluto y del 43 % relativo en la Mortalidad del día 28 (variable secundaria clave) en la población general del ensayo. Entre la subpoblación de pacientes con niveles del marcador de activación de la vía TREM-1, TREM-1 soluble (sTREM-1) por encima de la mediana, la reducción absoluta y relativa de la mortalidad fue aún más pronunciada, alcanzando un 20 % y un 47 %, respectivamente .
El Estudio Mostró Que NANGIBOTIDE tiene un Impacto Significativo y Positivo en la Progresión de la Enfermedad en Pacientes Que Reciben Soporte Ventilatorio Debido a COVID-19, así Como en la Gravedad de la Insuficiencia Respiratoria y la Duración de la Estancia en la UCI .
El Ensayo Mostró que sTREM-1 es un marcador de pronóstico eficaz en casos graves de COVID-19 y, de acuerdo con los resultados del estudio anterior ASTONISH de la compañía, confirmó que sTREM-1 es un marcador predictivo de una respuesta positiva al tratamiento con NANGIBOTIDE .
Jean-Jacques Garaud, vicepresidente senior de asuntos científicos y médicos de Inotrem, dijo: "Este nuevo ensayo aporta pruebas convincentes de que la vía TREM-1 desempeña un papel central en las principales desregulaciones inmunitarias que ponen en peligro la vida causadas por infecciones graves, ya sean graves formas de COVID-19 o shock séptico. Este estudio sugiere fuertemente que la nangibotida, que se dirige a TREM-1, es agnóstica a los patógenos y tiene el potencial de tratar las afecciones inflamatorias muy graves causadas por infecciones virales y bacterianas". ...
26 octubre 2022
Organizada por Pharmamar . Conferencias Sobre la Ivestigación Inspirada en el Mar . La Incubadora de Ideas de Hoy Nos ha Enseñado Cómo Mejorar en Salud Gracias al Mar . Celebrada en el Hospital San Carlos de Madrid .
José María Fernández Sousa :
*.- El Ensayo de Fase III Neptuno con APLIDIN Va Muy Lento Ya Que A los Pacientes Primero Hay Que Administrarles lo Que Hay en el Mercado .
*.- De Conseguir APLIDIN Oral ... Habría Que Empezar de Cero .
*.- A Finales de Año se Podría Realizar un Corte y Ver Que Resultados Aporta Dicho Ensayo de Fase III ... De Ser Satisfactorios Se Presentarían a las Agencias Reguladoras para Saber su Opinión ... Mientras Lógicamente el Ensayo Sigue Su Curso Hasta su Conclusión .
*.- Dado Que APLIDIN Se Ha Administrado en USO COMPASIVO en Pacientes InmunoDeprimidos y Se Han Observado Respuestas Positivas ... Se está Diseñando un Ensayo de Fase II-III Para este Tipo de Pacientes .
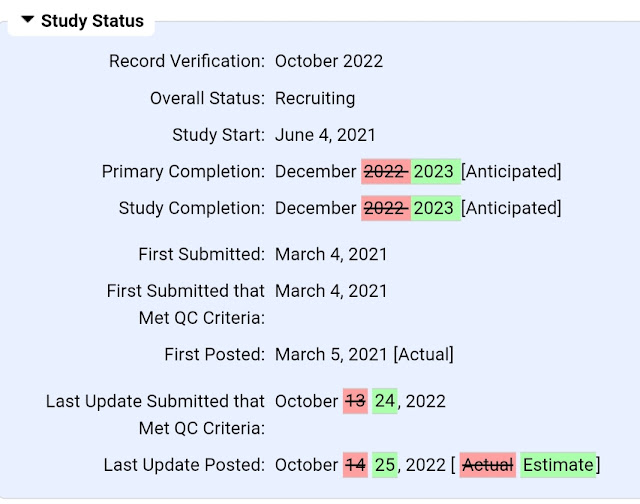
LURBINECTEDIN . La FDA Responde al Bufete de Abogados Foley Hoag, Que Buscan Retirar la Aprobación de Zepzelca Debido al Fracaso del Ensayo de Confirmación Atlantis ...y Explica el Por Qué No Retirará la Aprobación Acelerada de JazzPharma .
26 Octubre 2022 . By Zachary Brennan . Editor Jefe .
Si bien la inyección, conocida como Zepzelca (lurbinectedina), dio en el blanco en cuanto a la tasa de respuesta general, proporcionando lo suficiente para obtener su visto bueno acelerado en junio de 2020, pero luego falló en un punto final de supervivencia general seis meses después como parte de un estudio de Fase III que fue destinado a ser el ensayo confirmatorio.
Tanto el patrocinador, otros expertos y ahora la FDA, señalan que el ensayo no cubrió exactamente para qué fue la aprobación.
En respuesta a una petición presentada ante la FDA por el bufete de Abogados Foley Hoag, que busca retirar la aprobación de Zepzelca debido al fracaso del ensayo de confirmación, la agencia explicó :
Aunque la FDA está de acuerdo en que los resultados del ensayo ATLANTIS no son adecuados para verificar y describir el beneficio clínico de Zepzelca en pacientes con SCLC metastásico, no estamos de acuerdo en que la FDA deba iniciar procedimientos para retirar la aprobación de Zepzelca con base en los resultados del ensayo ATLANTIS. juicio en este momento. Cuando un ensayo confirmatorio no alcanza su criterio de valoración, no significa necesariamente que el fármaco no sea eficaz para la indicación aprobada mediante aprobación acelerada.
Pero ese consejo parece contradecir directamente lo que la FDA le dijo a Covis Pharma la semana pasada en su audiencia para obtener otra aprobación acelerada para su medicamento para el parto prematuro Makena. En ese caso, la FDA dijo que la carga de la prueba recae en la compañía para demostrar que su medicamento tiene beneficios clínicos en su ensayo de confirmación (lo que Covis y los propietarios anteriores de Makena no lograron). ...




.jpeg)



.png)





.jpeg)







.jpeg)



.png)
.jpeg)

.jpeg)











.jpeg)



.jpeg)