El Medicamento de los 1.000 Millones con el que PharmaMar quiere Resucitar .
La Salida al Mercado en 2020 de Zepsyre, el Tercer Antitumoral de la Farmacéutica, podría implicar un antes y un después para PharmaMar.
DIANA FRESNO // 18.12.2019 .
PharmaMar anunciaba este martes algo que llevaba dejando entrever desde hacía meses. Su nuevo tratamiento antitumoral, bautizado como Zepsyre, ha presentado de manera oficial ante la Administración de Medicamentos y Alimentos Estadounidense (FDA, por sus siglas en inglés) para su aprobación en Estados Unidos.
Si logra luz verde por parte de la FDA, cuya decisión se conocerá en el tercer trimestre de 2020 -según han comunicado a Vozpópulifuentes de la propia farmacéutica- supondrá un antes y un después en la historia de PharmaMar, que en los últimos años ha sido protagonista de subidas estratósfericas en Bolsa al mismo tiempo que registraba pérdidas millonarias.
¿Pero qué tiene Zepsyre que pueda cambiar el rumbo de PharmaMar? Por un lado, se trataría del Segundo Medicamento contra el cáncer que logra lanzar en Estados Unidos desde Yondelis, del que a día de hoy dependen sus cuentas. Para poder poner en marcha Zepsyre, cuyos estudios clínicos han durado años, ha invertido cerca de 50 millones de euros.
Cerca de 1.000 millones de facturación
Por otro, de lograr la aprobación de la FDA en 2020, las ventas de este nuevo medicamento, indicado para el cáncer de pulmón microcrítico o de células pequeñas, podrían reportar a la farmacéutica gallega cerca de 1.000 millones de euros al año, de acuerdo con fuentes consultadas por este periódico.
Es importante destacar que PharmaMar ha logrado que registrar de manera oficial una solicitud de aprobación 'acelerada', un tipo de proceso regulatorio reservado para medicamentos que responden a una necesidad médica no cubierta. De esta manera, podrá acceder al mercado estadounidense sin necesidad de llevar a cabo ensayos clínicos de fase III.
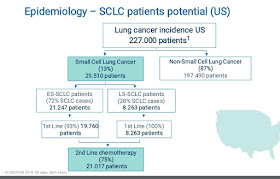
La realidad es que el cáncer de pulmón microcrítico es una de las patologías oncológicas más abandonadas del sistema farmacéutico, a pesar que es mucho más difícil de tratar que el cáncer de pulmón normal y supone el 15% de los casos.
De acuerdo con la prestigiosa American Cancer Society, se producen cerca de 200.000 muertes al año por culpa de este tipo de cáncer. Sólo en la Unión Europea, se registran 61.3000 nuevos casos al año, mientras que en EEUU rondan los 35.000 anuales.
El último medicamento efectivo contra esta enfermedad, el topotecán, se aprobó hace más de 20 años, en 1996. A día de hoy, el cáncer de pulmón de células pequeñas es uno de los más mortales: la tasa de supervivencia para los afectados es inferior al 30%.
Un antes y un después
De lograr la aprobación de la FDA, PharmaMar tendrá acceso a un mercado valorado en más de 2.000 millones, lo que puede darle un vuelco a sus cuentas. No las tenían todas consigo, ya que intentar utilizar la lurbinectedina -el nombre genérico de Zepsyre- para tratar el cáncer de pulmón no fue su primera opción.
El año pasado la farmacéutica recibió la negativa por parte del equivalente europeo a la FDA, la Agencia Europea del Medicamento, para comercializar Zepsyre para el cáncer de ovario, su opción inicial. Como consecuencia, sus acciones cayeron drásticamente.
El laboratorio liderado por Jose María Fernández de Sousa se encuentra claramente en un punto de inflexión.
Según las últimas cuentas disponibles, correspondientes al tercer trimestre de 2019, PharmaMar registró unas pérdidas de 27 millones de euros.
La facturación hasta septiembre fue de 62,4 millones de euros, lo que supone una reducción del 30% respecto al ejercicio precedente. Más del 70% correspondieron a Yondelis. Algo que PharmaMar espera que cambie dentro de muy poco.
TARLATAMAB TRAS LA APROBACIÓN COMPLETA EN ESTADOS UNIDOS PARA EL TRATAMIENTO SMALL CELL LUNG CANCER EXTENSIVE-STAGE ... AHORA LE TOCA EL TURNO DE CONSEGUIR LA FULL APPROVAL EN EUROPA ... LA EMA PODRÍA DAR SU BENDICIÓN EN LA REUNIÓN DE MARZO .
18 diciembre 2019
Genómica SAU ( PharmaMar Group ) se Posiciona con los Resultados Comparativos Obtenidos de su Sistema de Genotipado para Citología Líquida .
Nuevas Herramientas para Detectar Precozmente el VPH .

Genomica presenta los resultados comparativos de su sistema de genotipado para citología líquida en el congreso Eurogin 2019 .
La Razón | MADRID / 18-12-2019 .
La empresa de diagnóstico molecular Genomica, del Grupo PharmaMar, ha presentado una comunicación oral en el congreso internacional multidisciplinar sobre el virus del papiloma humano (VPH) Eurogin 2019, celebrado del 4 al 7 de diciembre en Mónaco y que reúne a profesionales y especialistas para abordar las necesidades en la detección y tratamiento del VPH.
En este contexto, la doctora Ditte Møller Ejegod del Departamento de Patología del Hospital Universitario de Copenague (Hvidvore), presentó los resultados de un estudio comparativo sobre el uso de la tecnología CLART HPV4s en citología líquida SurePathTM, un avance en el diagnóstico temprano del VPH.
El abstract, titulado “Comparison between BD onclarity, Roche cobas, Agena massarray HPV and Genomica CLART HPV4 with Surepath cervical screening samples using the Valgent framework” analiza los resultados obtenidos del genotipado del panel Valgent4 con cuatro métodos diferentes. El panel consiste en 1.295 muestras de SurePathTM de cuello de útero y se ha analizado con: CLART HPV4s, de Genomica, OnclarityTM HPV Assay (BD), HPV MassArray (Agena Bioscience) y cobas HPV (Roche). Este estudio demuestra que la tecnología CLART cumple con las pautas internacionales de sensibilidad, especificidad y reproducibilidad en las muestras de detección de cáncer de cuello uterino SurePathTM. Los resultados obtenidos en este estudio multicéntrico permiten explorar la posibilidad de utilizar el genotipado en el cribado primario de cáncer de cérvix en muestras de SurePathTM.
Existen más de 100 tipos de VPH diferentes, entre los que se encuentran los que tienen un mayor riesgo de derivar en un cáncer de cérvix. Para la detección del virus es necesario realizar una recogida de muestras de citología del cuello uterino. Actualmente, se utiliza el sistema de citología en base líquida, ya que se obtienen mejores resultados en la detección de las lesiones cervicales precancerosas. Uno de estos sistemas de recogida de muestras muy utilizado es SurePathTM. Con la tecnología CLART HPV4 se pueden genotipar muestras recogidas con este sistema en el cribado de cáncer de cérvix.
570.000 nuevos casos .
El VPH es la infección de transmisión sexual más común en el mundo que puede provocar cáncer. Según las estadísticas, entre un 75-80% de hombres y mujeres sexualmente activos pueden contraer este virus en algún momento de su vida, siendo el responsable del 10% de los casos de cáncer de cérvix en mujeres. En la actualidad, la tecnología desarrollada por Genomica permite identificar el tipo concreto de VPH que sufre la paciente y evaluar el riesgo de padecer un tumor.
El cáncer de cérvix es la cuarta neoplasia más frecuente en mujeres con 570.000 nuevos casos cada año, lo que representa casi el 7% de todos los cánceres femeninos. El principal origen del cáncer cervical es el VPH, del cual se ha demostrado que un número creciente de subtipos son tipos de alto riesgo para el cáncer. Dicha tasa de mortalidad por cáncer cervical podría reducirse mediante la prevención, el diagnóstico temprano y la detección efectiva.
PharmaMar . Recordando la Presentacion del Dossier a la EMA del Yondelis ...
Un Dossier compuesto por 43.800 Páginas y que tuvo su Anécdota : Esperando la Documentación en CD la cual se demoró ... lo que provocó que la Furgoneta se presentara a las 16,20 al muelle de la EMA ... con tan solo 10 Minutos de antelación al Cierre de dicha Sede fijada en las 16,30 .
 |
| Furgoneta con el Dossier del Yondelis a su llegada al Muelle de la EMA . |